Desatero pro rodiče
Onkologické onemocnění dítěte je pro rodiče velmi náročné životní období. Zde je několik užitečných doporučení, na které bývá dobré myslet. Desatero si můžete stáhnout zde.
Diagnostické a zobrazovací >>>>
Principy onkologické léčby >>>>
Biologie nádoru
Podstata:
Podstatou nádorového růstu je množení určitých buněk v těle, které se vymklo přirozeným regulačním mechanismům. Vzniká stále rostoucí populace buněk, které jsou abnormální jak svým uspořádáním, tak svou funkcí a navíc postupně utlačují populaci buněk zdravých, mluvíme o tzv. klonální proliferaci. Abnormální populace buněk (klon) může začít růst v kterémkoliv orgánu lidského těla. Důvod, proč se najednou určitá část buněk vymkne, jinak perfektní, kontrole není zatím zcela jasný. Především u dětských nádorů je předpoklad, že svou roli bude hrát určitá genetická dispozice, vrozená porucha , která svým způsobem činí organismus zvýšeně citlivým na další rakovinotvorné vlivy z okolí. Organismus má sníženou schopnost napravovat spoustu drobných genetických chyb a poškození , které běžně vznikají u každého z nás, ať už v průběhu normálního procesu obnovování buněk, či vlivem virových infekcí atd. Časem dojde k tomu, že nakupení neopravovaných chyb dojde do kritického momentu, kdy dá vznik nádorovému klonu buněk a jeho dalšímu nekontrolovanému množení.
Teorie prvotní genetické poruchy je sice nejrozšířenější, ale ne jedinou teorií o vzniku nádorového bujení. Jisté je, že klíč k úspěšné léčbě nádorového bujení, je právě v detailním pochopení prvotních genetických změn a odhalení klíčových momentů, kdy kontrola selže. Pokud budeme schopni u každého jednotlivého nádoru odhalit a současně i napravit chybu v řízení buněčného dělení, bude léčba zřejmě daleko úspěšnější a i příjemnější. Přes ohromnou spoustu práce, která v této oblasti byla v posledních deseti letech udělána, je klinické využití poznatků zatím malé. Problémem je především ohromné množství potencionálních genetických poruch a buněčných linií, které mohou dát vznik nádoru, přičemž každá je kontrolována poněkud jinými mechanismy. Navíc, i když se podaří pro určitý typ nádoru specifikovat poruchu v řízení buněčného dělení, je nesmírně složité tuto poruchu v organismu napravit, tak aby se nádorové dělení zastavilo nebo dokonce vymizelo.
Nádory u dětí:
Jak již bylo řečeno, morfologicky a funkčně abnormální populace nádorových buněk se nekontrolovaně množí v organismu. Rychlost tohoto množení je velmi variabilní a záleží především na typu nádoru. Existují jak typy nádoru s velmi pomalým růstem, tak nádory, které zdvojnásobí svoji velikost za šest hodin. Obecně platí, že dětské nádory patří většinou mezi ty rychle rostoucí a současně i více citlivé na chemoterapii ve srovnání s nádory dospělého věku. Biologických odlišností mezi nádory dětského a dospělého věku je vícero a absolutně nelze zkušenosti z léčby dospělých nádorů jednoduše přenášet na děti.
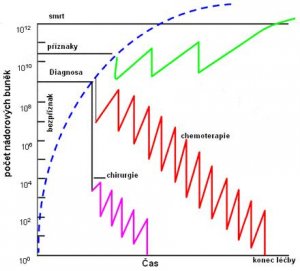
V okamžiku, kdy je nádor poprvé zachytitelný na zobrazovacích metodách (rentgen, ultrazvuk...) měří zhruba 1 cm a váží 1 g . Již v této době čítá přibližně 1 miliardu buněk (1x108) . V té době ale nádor zpravidla nečiní žádné klinické obtíže, a tak je v naprosté většině případů diagnostikován daleko později, v době , kdy se počet buněk v nádoru pohybuje okolo 1x 1010. V tomto okamžiku se nemusí všechny buňky nádoru již aktivně množit, naopak množící se buňky mohou být v menšině a většina buněk je tzv. spících. Naprostá většina cytostatik v běžných dávkách je účinná pouze na buňky aktivně se množící. Spící buňky tak představují podstatnou část masy nádoru k účinku cytostatika necitlivé. Ve chvíli, kdy je populace dělících se buněk zredukována účinkem cytostatik na kritickou mez, část nečinných buněk se probouzí a začíná se dělit, aby zlikvidované nádorové buňky nahradila. Pokud je v tento moment opět podáno cytostatikum, podaří se postupně zničit i tuto zbývající populaci. Zde hledejme i vysvětlení, proč je léčba nádoru dlouhodobá a probíhá v určitých cyklech. Situace je schematicky znázorněná na přiloženém grafu. Principy léčby cytostatiky (chemoterapie) jsou rozvedeny v jiném oddíle těchto stránek.
Metastázy:
Charakteristickou vlastností nádoru je, mimo lokálního útlaku a destrukce, i vytváření nových ložisek nádoru v orgánech vzdálených původnímu ložisku. Mluvíme o tzv. metastázách. Schopnost vytvářet metastázy závisí na biologických vlastnostech každého jednotlivého nádoru a nelze rozhodně hledat souvislost mezi velikostí nádoru a pravděpodobností metastazování. I velmi malé nádory již mohou mít metastázy v jiných orgánech a naopak. Každý pacient je při diagnose zhoubného nádoru detailně vyšetřen v rámci procesu tzv. stážování, kdy hledáme možné vzdálené metastázy. Přítomnost či nepřítomnost metastáz totiž má zásadní vliv na určení klinického stadia (pokročilosti a rozsahu) nádoru a tím i na nastavení léčebné strategie. Přehlédnutí metastáz a špatné nastavení počáteční léčby může mít velmi neblahé důsledky na konečný osud pacienta. Několikadenní pečlivé vyšetřování pomocí zobrazovacích metod jako je magnetická rezonance (NMR), počítačová tomografie (CT), scintigrafie, rentgen atd. je v okamžiku diagnosy nádoru zcela nezbytné. O diagnostických a zobrazovacích metodáchse dočtete více ve speciálním oddíle těchto stránek.
Diagnostické a zobrazovací metody
Diagnostické a zobrazovací metody v onkologii:
V procesu vyšetření pacienta pro podezření na nádorové onemocnění se v žádném případě neobejdeme bez zobrazovacích vyšetření. Jejich úkolem je přinést informaci o uložení nádoru, jeho velikosti a vztahu k ostatním orgánům. Jak již bylo uvedeno v kapitole biologie nádoru, neméně důležitou roli mají zobrazovací metody v detekci případných metastáz nádoru. V neposlední řadě je nutné před zahájením intenzivní chemoterapie s potencionálními závažnými vedlejšími účinky mít přehled o výchozím funkčním stavu životně důležitých orgánů, jako je např. srdce, játra, ledviny atd. Přítomnost nádorových buněk v kostní dřeni nelze zobrazovacími metodami spolehlivě posoudit. Zde je nutné použít invazivnější vyšetření, tzv. punkci kostní dřeně.
Sled vyšetření a paleta jednotlivých metod je individuální a šitá na míru každému pacientu, podle toho, na který typ nádoru máme podezření. Je nutné si uvědomit, že neexistuje jedno univerzální celotělové vyšetření, které by s definitivní platností potvrdilo, či vyloučilo nádor kdekoliv těle. Každý pacient je tak v procesu diagnostiky nádoru vystaven poměrně náročnému vyšetřovacímu procesu, který je ale zcela nezbytný pro správné nastavení léčby. Jsme si vědomi, že pro dítě a jeho rodiče se jedná o velmi složité období a naší snahou je počet vyšetření snížit na nezbytně nutné minimum.
Všechna vyšetření se dále v průběhu léčby v určitých intervalech opakují, s cílem zjistit úroveň odpovědi nádoru na podávanou léčbu, tak abychom mohli léčebný postup případně včas modifikovat. Zobrazovací vyšetření samozřejmě slouží nejenom k detekci nádoru samotného, ale často i k detekci komplikací onkologické léčby.
V následujícím souhrnu vás stručně seznámíme s principy nejčastěji používaných diagnostických metod.
- Ultrazvuk (ODKAZ)
- Rentgen (rtg) (ODKAZ)
- Počítačová tomografie (computed tomography, CT) (ODKAZ)
- Magnetická rezonance (ODKAZ)
- Pozitronová emisní tomografie (PET) (ODKAZ)
- Vyšetření kostní dřeně (ODKAZ)
- Vyšetření mozkomíšního moku (ODKAZ)
- Histologické vyšetření (ODKAZ)
Ultrazvuk:
Ultrazvuk (UZ, ECHO, USG)patří k základním vyšetřovacím metodám v dětském věku. Jeho obrovskou výhodou je absence radiační zátěže, snadná dostupnost a rychlost. Je možné jej také často opakovat. Je vyšetřením první volby při pátrání po nádoru v dutině břišní, pokud je vysloveno klinické podezření. Určitou nevýhodou je nižší přesnost v určení prostorového uspořádání nádoru, toto vyšetření většinou není samo o sobě dostatečné před plánovanou operací. Další limitací může být neklid (pláč) dítěte, kdy často u kojenců není možné vyšetření provést bez farmakologického zklidnění.
Vyšetření nevyžaduje zvláštní přípravu. Pro ultrazvukové vyšetření břicha je lépe, pokud je pacient 3 hodiny před vyšetřením lačný, aby se minimalizoval obsah plynu ve střevech. Naopak by pacient měl pít čisté tekutiny (čaj, voda), tak aby v době vyšetření měl naplněný močový měchýř.
Rentgen (rtg):
Rentgenové snímky mají stále svou nezastupitelnou úlohu ve vyšetřovacím postupu po nádorová i jiná onemocnění dětského věku. Například rentgenový snímek hrudníku je základním vyšetřením pro každého pacienta s podezřením na nádor. V případě, že tento snímek prokáže nějakou patologii, či je míra podezření na případné nitrohrudní metastázy vysoká, navazuje na rtg snímek i vyšetření počítačovou tomografií.
Radiační zátěž spojená s rtg snímkem je skutečně minimální a i v případě opakovaného snímkování se není nutno obávat případného radiačního poškození. Přínos rtg vyšetření mnohonásobně převyšuje rizika radiační zátěže.
Počítačová tomografie (computed tomography, CT):
CT patří k náročnějším, ale velmi přesným a citlivým vyšetřením. Často navazuje na úvodní vyšetření ultrazvukem či prostým rentgenem. Součástí CT vyšetření bývá, mimo prostých CT snímků, i vyšetření po podání rentgen kontrastní látky do žíly. Cílem je zjistit míru prokrvení daného orgánu či nádoru. Při vyšetření břicha bývá často podán kontrast ústy ve formě nápoje, tak aby se orgány zažívacího traktu odlišily od ostatních orgánů dutiny břišní. CT vyšetření vyžaduje klid pacienta a často i jeho dobrou spolupráci, např. při vyšetření plic. U malých dětí je proto většinou nutné provádět CT v celkové anestezii, tak aby bylo dosaženo kvalitního výsledku a vyšetření nebylo zbytečně opakováno.
Důležitou informací před prováděním CT je případná alergie pacienta na jód. V tomto případě nesmíme podat kontrastní látku do žíly. Každopádně všem pacientům jsou před podáním kontrastní látky podány léky (antihistaminika) ke zmírnění případné alergické reakce na jód.
Před vyšetřením je vhodné, aby děti byly lačné. Vyšetření samo trvá 30 - 60 minut, což i pro starší děti bývá někdy zatěžující.
Radiační zátěž je při CT desetinásobná v porovnání s rentgenovým snímkem. I tak ale počet CT vyšetření běžně prováděný v průběhu diagnostiky a léčby u každého jednotlivého pacienta nedosahuje kritických hodnot znamenajících možné budoucí postradiační komplikace.
K vydání CT nálezu musí radiolog velmi pečlivě prohlédnout všechny snímky a porovnat je s výsledky ultrazvuku atd. Výsledek CT vyšetření proto není vydáván okamžitě, ale často až za několik hodin nebo druhý den. Prosíme buďte trpěliví a nežádejte výsledek po radiologovi ihned po vyšetření.
Magnetická rezonance:
Nukleární magnetická rezonance (NMR, MRI)patří mezi nejsložitější vyšetřovací metody. Složitosti vyšetření odpovídá i jeho cena, která se pohybuje v řádech desetitisíců korun. Pro srovnání, cena CT vyšetření představuje řádově stovky korun. Principem NMR je počítačové sledování změn chování různých buněk v lidském těle působením silného magnetického pole. Vyšetření nepředstavuje radiační zátěž, působení silného magnetického pole však s sebou nese určité limitace vyšetření. NMR nesmí být např. provedeno u pacientů majících v těle kovový materiál (nejčastěji po neurochirurgických operacích) či kardiostimulátor. Vyšetření je poměrně dlouhé (60 - 180 minut) a klade vysoké nároky na spolupráci pacienta. Některá vyšetření (např. NMR páteře) se proto rozkládají do dvou dnů. U malých dětí je opět vyšetření prováděno v celkové anestezii.
NMR patří již k velmi přísně indikovaným vyšetřením, ne u každého pacienta vyšetřovaného a léčeného pro nádor je nutné jej provádět. Taktéž se nejedná o vyšetření dostupné běžně 24 hodin denně. Stejně jako u CT vyšetření, i zde je vyhodnocení snímků náročné a výsledek proto nemůže být vydán ihned po vyšetření.
Pozitronová emisní tomografie (PET):
Jedná se o jednu z nejmodernějších a nejnovějších metod v onkologii, která slouží ke zhodnocení biologické povahy nádoru a vyhledávání ložisek metastáz. Principem vyšetření je nitrožilní podání malého množství radioaktivně značené glukosy, která se následně vychytává v buňkách s vysokou metabolickou aktivitou, jako jsou právě nádorové buňky. Vyšetření nemá však stejnou citlivost pro všechny nádory a tak není prováděno u všech pacientů.
Metoda PET je velmi složitá a vyžaduje velmi dobrou spolupráci pacienta před a i v průběhu vyšetření. Pokud spolupráce pacienta není dobrá, může být výsledek vyšetření zatížen chybou. Radiační zátěž vyšetření je malá, srovnatelná s dvěma rentgeny hrudníku. Velmi důležité je i načasování PET. Nedodržení správného časového odstupu od operace, radioterapie či chemoterapie by mohlo přinést falešné výsledky vyšetření.
PET vyšetření se provádí na dvou místech v ČR - v Nemocnici na Homolce v Praze a v Masarykově onkologickém ústavu v Brně. Na vyšetření je nutno pacienta objednat, čekací doby jsou obvykle několik dní. Veškeré bližší informace ohledně PET vyšetření získáte na adrese Masarykova onkologického ústavu.
Vyšetření kostní dřeně:
Vyšetření kostní dřeně se provádí v situaci, kdy máme podezření na nádorové onemocnění z kostní dřeně vycházející (leukemie) nebo druhotně kostní dřeň metastaticky postihující. V současné době patří mezi rutinně prováděná vyšetření u většiny onkologicky nemocných pacientů. Principem je odběr vzorku kostní dřeně a následné vyšetření vzorku pod mikroskopem a ve specializovaných imunologických a molekulárně genetických laboratořích. Současně se většinou odebírá i vzorek kostní tkáně k vyšetření v patologických laboratořích. Kostní dřeň se odebírá jedním vpichem dutou jehlou a to u kojenců z přední strany holenní kosti, u starších dětí z hrudní kosti nebo z horního okraje kosti kyčle. Vzorek kostní tkáně se odebírá taktéž vpichem dutou jehlou a to z obou horních okrajů kyčelní kostí.
Vyšetření se bez ohledu na věk pacienta vždy provádí v celkové anestezii na operačním sále. Výkon trvá cca 20 minut a po výkonu děti dostávají léky tlumící bolest. Většinou ale po vyšetření není bolest problémem a rány se v průběhu 2 - 3 dní zcela zahojí.
Výsledky vyšetření lze v akutních situacích očekávat ještě týž den, ale velmi často je nutné vyčkat několik dní na výsledky z ostatních laboratoří k vytvoření definitivního závěru.
Vyšetření mozkomíšního moku:
Mozkomíšní mokneboli liquor je tekutina, která tvoří přirozené prostředí mozku a míchy (CNS). Zajišťuje ochranu mozku a míchy před otřesy a tvoří v podstatě bariéru mezi CNS a prostředím organismu. Mozkomíšní mok je produkován v oblasti postranních mozkových komor, cirkuluje přes třetí a čtvrtou komoru mozkovou a dále v durálním vaku podél míchy. Průběžně probíhá vstřebávání liquoru ve všech oblastech CNS. Biochemické složení liquoru je za normálních okolností velmi stabilní a je pečlivě organismem udržované. Za patologických procesů v CNS se ale z CNS do liquoru vylučují proteiny, cukry, produkty bakterií, virů, plísní, krevní elementy nebo nádorové buňky. Změny v liquoru jsou velmi přesným ukazatelem změn v CNS. Vyšetření mozkomíšního moku je tak nezbytným vyšetřením v případech, kdy čekáme změny v oblasti CNS v důsledku základního onemocnění nebo jeho komplikací.
Díky bariérové funkci liquoru mají nitrožilně podané léky velmi špatný průnik do oblasti CNS. U nemocí, kde předpokládáme snadné rozšíření nemoci do oblasti CNS nebo kde již k tomuto rozšíření došlo, např. u leukemií, je nutné podávat cytostatika přímo do mozkomíšního moku.
Odběr vzorku mozkomíšního moku a podávání léků se provádí tzv. lumbální punkcí. Jedná se o vpich speciální tenkou dutou jehlou v oblasti lumbální páteře, kdy se pronikne mezi těly obratlů přes durální vak . Výkon se provádí u dětí buď v krátké celkové anestezii na operačním sále nebo na oddělení v tzv. analgosedaci , kdy je dítě částečně při vědomí, ale na výkon si zpětně nepamatuje. Pokud je výkon prováděn na oddělení v analgosedaci, dítě sedí v tureckém sedu s vyhrbenými zády. Výkon provádí vždy lékař a asistují zkušené sestry, které pomáhají upravit polohu dítěte. Celý výkon trvá většinou cca 5 minut. Vzhledem k nutnosti anestezie nedovolujeme dětem minimálně 2 hodiny před výkonem jíst a pít.
Ke snížení rizika rozvoje tzv. postpunkčního syndromu, který se projevuje bolestmi hlavy a zvracením, se doporučuje minimálně dvě hodiny po výkonu ležet s hlavou na rovině nebo dokonce v lehce snížené poloze. I v případě, že se lumbální punkce provádějí ambulantně, doporučujeme po příjezdu domů také ještě dodržovat klidový režim vleže a popíjet hodně tekutin.
Histologické vyšetření:
Všechna výše uvedená vyšetření nám popíší velikost tumoru, jeho vztah k okolním orgánům a s jistou přesností nám napoví o jaký tumor by se mohlo jednat. Definitivní odpověď na otázku, z kterých buněk nádor vychází, nám ale dá pouze přímé vyšetření vzorku tumoru v patologické laboratoři, tzv. histologie. Výsledek histologického vyšetření je zcela zásadní pro stanovení dalšího způsobu léčby. Mnoho nádorů může vypadat velmi podobně na zobrazovacích vyšetřeních, histologicky se ale může jednat o zcela rozdílné nemoci. Stejně tak některá nezhoubná onemocnění mohou na ultrazvuku či NMR vypadat jako nádor a až histologické vyšetření ukáže, že se o nádor nejedná. Jen ve zcela výjimečných případech, u tumorů jater nebo ledvin, je nález na zobrazovacích metodách v kontextu s klinickým obrazem tak přesvědčivý, že histologie není na začátku léčby vyžadována.
Vzorek pro histologické vyšetření se odebírá tzv. biopsií. Jedná se o operační výkon v celkové anestezii, kdy chirurg odebere malý vzorek tkáně z nádoru.
Vzorek tkáně je zpracováván v patologické laboratoři a dále v laboratořích cytogenetických a molekulárně genetických. Tato vyšetření jsou poměrně technicky náročná a přesný výsledek lze očekávat v průběhu několika dní.
Komplikace léčby
Úvodem:
Po přečtení kapitoly o biologii nádorua protinádorové léčběasi není zapotřebí širokého úvodu ke kapitole o komplikacích a nežádoucích účincích léčby. Protinádorová léčba bohužel stále ještě není zacílená pouze na samotný nádor a tak mimo mnoho dobrého napáchá i věci zlé. Klíč k úspěchu onkologické léčby tkví, mimo jiné, také ve znalosti možných komplikací, schopnosti je do jisté míry předvídat a včas a úspěšně léčit. Prakticky každý pacient se v průběhu léčby setká s nějakou komplikací. Paradoxně často děti působí v době diagnosy daleko méně nemocným dojmem než po zahájení léčby, což rodičům, pokud o tomto nejsou předem poučeni, působí zbytečný stres.
Po přečtení této kapitoly můžete být zděšeni množstvím komplikací zde popsaných. Mějte však na paměti, že u žádného pacienta se neprojeví všechny nežádoucí účinky. Navíc komplikace mají různou intenzitu, od lehce ambulantně zvladatelných až po život ohrožující stavy s nutností velmi intenzivní léčby.
K včasnému rozpoznání a léčbě všech komplikací je nutné, aby byl rodič nebo opatrovník dítěte nejenom poučen o možných příznacích, ale současně aby vše lékaři neprodleně sdělil. I zdánlivě banální příznak může signalizovat začátek potenciálně závažné komplikace. Komplikace se do jisté míry liší v závislosti na použitém léku a či kombinaci léků a zkušený onkolog tak může rodiče dopředu poučit, na jaké příznaky mají dávat pozor.
Členění:
Problematika komplikací onkologické léčby je co do obsahu i počtu témat poměrně obsáhlá, proto byl text rozdělen do následujících podkapitol:
- Poškození krvetvorby cytostatiky (ODKAZ)
- Infekce u onkologicky nemocných (ODKAZ)
- Nevolnost a zvracení (ODKAZ)
- Průjem (ODKAZ)
- Zácpa (ODKAZ)
- Poškození sliznice dutiny ústní a krku (ODKAZ)
- Nežádoucí účinky chemoterapie na vlasy a kůži (ODKAZ)
- Nežádoucí účinek chemoterapie na nervovou soustavu (ODKAZ)
- Nežádoucí účinky chemoterapie na pohlavní ústrojí a plodnost (ODKAZ)
- Nežádoucí účinky kortikoidů - Prednisonu a Dexamethasonu (ODKAZ)
Poškození krvetvorby cytostatiky
Postižení kostní dřeně:
Krvetvorné buňky patří k nejrychleji se dělícím buňkám v organismu a jsou účinkem cytostatik postiženy nejvíce. Postižení kostní dřeně cytostatiky, tzv. myelotoxicita, je limitujícím faktorem většiny léčebných protokolů. Po cyklu léčby dojde prakticky vždy k poklesu jednotlivých krvetvorných řad a další cyklus může být zahájen pouze tehdy, pokud dochází již k obnově poškozené krvetvorby. S každým dalším cyklem se ale situace opakuje. Vývoj počtu krvinek se po celou dobu léčby podobá křivce s pravidelnými poklesy a vzestupy.
Krvetvorba sestává ze 3 základních řad:
- bílé krvinky (leukocyty)
- červené krvinky (erytrocyty)
- krevní destičky (trombocyty)
Pokles každé z těchto řad má trochu jiné důsledky a tak budou rozebrány zvlášť.
Pokles bílých krvinek po chemoterapii:
Bílé krvinky (leukocyty, zkratka Leu, WBC)jsou extrémně důležitou zbraní organismu v boji proti infekci. Logickým důsledkem poklesu bílých krvinek po chemoterapii je tedy významně snížená odolnost pacienta vůči infekci. Pokles bílých krvinek po cyklu chemoterapie nazýváme leukopenie. Leukocytů je několik typů a pro obranu proti infekci jsou nejdůležitější tzv. neutrofily. Při leukopenii nás vždy zajímá i počet neutrofilů (absolutní počet neutrofilů, ANC). Ten je ve výsledku krevního obrazu většinou udáván v procentech z počtu leukocytů a absolutní hodnotu lze snadno spočítat. Za hranici, od kdy je obranyschopnost organismu skutečně vážně narušena, je považována hodnota neutrofilů pod 0,5x109/l, tj. ANC pod 500/µl. Riziko infekce je úměrné hloubce a délce trvaní leukopenie resp. neutropenie. Jako kritická hranice pro velmi závažné infekce se udává neutropenie s hodnotu ANC pod 500 trvající déle než 10 dní. Ve většině případů dosahují neutrofily nejnižšího počtu (tzv. nadir) za 3- 7 dní po cyklu léčby, kdy mohou hodnoty být zcela nulové. Reparace nastává u běžných chemoterapií do 3- 4 týdnů po začátku cyklu léčby. Krevní destičky a červené krvinky se za tímto vývojem opožďují, což je dáno rozdílnou délkou života leukocytů, trombocytů a erytrocytů.
Febrilní neutropenie:
Jak již bylo řečeno, v době neutropenie významně stoupá riziko infekce a stoupá i riziko jejího těžkého a rychlého průběhu. Z tohoto plynou zásadní režimová doporučení pro období neutropenie:
- Kontroly krevního obrazus počtem neutrofilů v intervalu 2 - 3 dní po cyklu léčby.
Tyto kontroly může pacient absolvovat i v místě bydliště. Jedná se o běžné vyšetření dostupné v každé hematologické laboratoři. Výsledek vyšetření je nutné oznámit na ambulanci KDO, kde dle aktuální hodnoty ANC dá onkolog doporučení stran dalšího režimu a kontroly krevního obrazu. - Ve chvíli, kdy je ANC pod 500/µl je doporučen dítěti speciální stravovací režim s cílem omezit rizika bakteriální a plísňové infekce. Bližší údaje najdete v kapitole režim dítěte průběhu onkologické léčby. Rodiče jsou poučeni o nutnosti kontrolovat celkový stav dítěte a tělesnou teplotu . Pozor!! V době neutropenie nelze měřit tělesnou teploty v zadečku.
- Pokud se v této době objeví u dítěte teplota nad 38,5°C nebo 3 x za sebou teplota mezi 38 a 38,4°C, mluvíme o tzv. febrilní neutropenii a ta je vždy důvodem k okamžité hospitalizaci dítěte a léčbě nitrožilními antibiotiky. Pokud tuto teplotu doma rodič naměří, je vždy nutné se spojit s lékařem KDO ( je přítomna 24 hodinová služba) a domluvit se s ním na dalším praktickém postupu. V každém případě doporučujeme již doma podat dítěti lék ke snížení teploty -antipyretikum. Vhodné jou běžně užívané léky - Paralen, Brufen ve fromě tablet či sirupu. Zcela nevhodné a nebezpečné je podávání léků s obsahem kyseliny acetylosalicylové - Acylpyrin, Aspirin, Anopyrin.
Průběh febrilní neutropeniese u každého pacienta může lišit. Prvotně nasazovaná antibiotika jsou u každého stejná a mají za cíl zasáhnout co nejširší spektrum bakterií. Velká část pacientů nepotřebuje další změnu léčby, jsou po několika dnech bez teploty a současně dochází ke vzestupu ANC. Mohou tak být propuštěni domů nebo pokračují dalším blokem cytostatické léčby. U menšiny pacientů, kde je spontánní vzestup granulocytů pomalejší, bývá průběh těžší, je nutné pro trvající teploty měnit antibiotika, přidávat protiplísňové léky atd. I tito pacienti se však většinou zbaví teploty v okamžiku, kdy ANC stoupne nad 500/µl.
Častá otázka rodičů je, co mohou udělat pro to, aby bílé krvinky či granulocyty po chemoterapii rychleji stoupaly zpět do normálních hodnot. Odpověď zní: "Nic".
Co však mohou rodiče udělata co není schopen udělat sebelepší lékař, je dodržovat doporučená režimová opatření v tomto období, chránit dítě před možnou expozicí infekci a včas o teplotě informovat lékaře.
V přísně indikovaných případech nejtěžších průběhů febrilní neutropenie lze podávat speciální lék tzv. granulocytární růstový faktor. Ten se podává injekčně pod kůži 1x denně a v kontrolovaných studiích bylo prokázáno, že urychluje nárůst granulocytů a zlepšuje prognosu dětí v těžké febrilní neutropenii. Vzhledem k tomu, že se neprokázal jeho účinek na zlepšení prognosy dětí v běžné neutropenii a má i řadu nežádoucích účinků, není rutinně podáván všem dětem.
Pokles krevních destiček (trombocytů) po chemoterapii:
Trombocyty jsou krevní elementy, které mají nezastupitelnou úlohu v procesu krevního srážení. Snížení jejich počtu pod normální mez se nazývá trombocytopenie. Nedostatek trombocytů logicky vede k poruše srážlivosti krve a u pacienta se mohou i po malém poranění snadno objevit modřiny či krvácení. Normální hodnota trombocytů se pohybuje od 250 do 400 x 109/l. Hodnota při které je značné riziko krvácení je pod 20 x 109/l. Nejčastějším projevem krvácení jsou modřiny a tzv. petechie. Jedná se o drobné tečkovité krvácení do kůže, nejčastěji v místě tlaku (kotníky, krk). Známkou toho, že riziko závažného krvácení je velké, je objevení se petechií na sliznicích dutiny ústní.
Rodiče dětí jsou vždy upozorněni v období trombocytopenie na zvýšené riziko krvácení a alarmující příznaky jako je krvácení v ústech, petechie na krku atd. Je nutné v tomto období dítě chránit před možných úrazem, uhozením do hlavičky apod. V případě objevení se krvácení či úrazu musí rodič neprodleně uvědomit lékaře na KDO a domluvit se na dalším postupu.
V období trombocytopenie se opouští čištění zubů kartáčkem a na místo toho se ústa vyplachují speciálními roztoky. Blíže viz v oddíle komplikace v dutině ústní.
Na rozdíl od granulocytů, lze trombocyty hradit transfuzemi dárcovských trombocytů. Indikací k transfuzi je jednak samotný počet destiček ( většinou při hodnotě pod 10 x 109/l) nebo závažnost krvácení. Samozřejmě, pokud je v období trombocytopenie nutný operační zákrok, transfuze trombocytů je podána taktéž. Transfuze trombocytů mohou být provázeny alergickými reakcemi, což je důvod proč jsou indikace k jejich podávání poměrně striktní.
Vzestup trombocytů je známkou obnovy krvetvorby po cyklu chemoterapie. Proto často i v případě , kdy má již pacient dobrý počet granulocytů, čekáme se zahájením dalšího cyklu i na spontánní ( transfuzí nepodporovaný) vzestup trombocytů.
Pokles červených krvinek (erytrocytů) po chemoterapii:
Hlavní úlohou erytrocytů v organismu je přenos kyslíku do buněk. V období, kdy je červených krvinek po cyklu chemoterapie nedostatek, mluvíme o tzv. anemii. Hloubka anemie se měří množstvím červeného krevního barviva, hemoglobinu, v objemu krve. Normální hodnota se pohybuje u dětí v závislosti na věku od 110 do 140 g/l.
Malé množství červených krvinek kapacitně nestačí potřebám organismu a ten trpí relativním nedostatkem kyslíku v tkáních. Anemie přetrvává v určité míře po celou dobu chemoterapie a mezi cykly většinou nedochází k úpravě do zcela normálních hodnot. Na druhou stranu, dětský organismus má velkou schopnost přivyknout a přizpůsobit své biochemické pochody nižšímu množství červených krvinek než je fyziologická norma. Jedná o tzv. adaptaci organismu na anemii. Tato schopnost organismu nám dovoluje vyčkat s transfuzí erytrocytů až na relativně nízké hodnoty hemoglobinu mezi 70 - 80 g/l. Spíše než absolutní hodnota hemoglobinu v tomto rozmezí rozhodují o transfuzi příznaky z anemie, což je zvýšená únava, pocit nedostatku dechu, pocit bušení srdce, tendence ke kolapsům. Všechny tyto příznaky je nutno sledovat a oznámit ošetřujícímu lékaři.
Mnoho rodičů se ptá, zda-li mohou dítěti poskytnout vlastní krev na transfuzi červených krvinek. Chápeme, že tato snaha je motivována obavou z reakce na "cizí" krev a očekáváním, že krev vlastních rodičů bude organismu bližší. Opak je však pravdou. Díky shodě určitých znaků na povrchu krvinek a jiných krevních elementů může u oslabeného pacienta právě rodičovská krev vyvolat nežádoucí závažnou reakci . Dárcovská krev s pacientem žádné shodné znaky ( mimo krevní skupinu) nesdílí a riziko této reakce je výrazně menší. Navíc v současné době je proces výroby krevních koncentrátů k transfuzi velmi pečlivě kontrolován, samotná krev je před podáním oslabenému pacientu zbavena bílých krvinek a ozářena . Riziko přenosu virových infekcí či závažných reakcí je tedy zcela minimální.
Pokrok v v medicíně jde rychle kupředu a v současné době máme k dispozici růstový faktor pro erytrocyty tzv. erytropoetin. Ten je normálně produkován v organismu ledvinami. V okamžiku protinádorové léčby jeho produkce nestačí zvýšeným nárokům na produkci krvinek. Pacientům je tak možné erytropoetin podávat ve formě podkožních injekcí 1x týdně. Tímto způsobem lze u většiny z nich snížit počet krevních transfuzí. Většinou však není možné se bez transfuzí obejít úplně.
Infekce u onkologicky nemocných
Původ a přenos infekcí:
Infekce zůstávají nejvážnější komplikací onkologické léčby a vedle malignity samotné také jednou z hlavních příčin úmrtí pacientů. Hlavními původci infekcí u pacientů v onkologické léčbě jsou bakterie. Plísně jsou méně časté, ovšem ve zdravé populaci závažnější infekce nepůsobí prakticky vůbec. Nejméně časté jsou infekce viry, ale opět, pokud k infekci dojde , projevy jsou daleko rychlejší a závažnější než v případě zdravé osoby infikované stejným virem.
Za normálních okolností má lidský organismus několik účinných mechanismů v obraně proti infekci. Jedná se především o:
- normální počet a funkci bílých krvinek
- neporušené sliznice
Jak je uvedeno v části o poškození krvetvorby, v průběhu léčby dochází opakovaně k poklesům počtu bílých krvinek na velmi nízké hodnoty. Pacient navíc trpí chronickým nedostatkem bílkovin díky jejich sníženému příjmu (nechutenství , zvracení) a snížené schopnosti organismu bílkovinu vyrábět. Nedostatek bílkovin se negativně odráží na funkci bílých krvinek a nedostatečné tvorbě protilátek.
Sliznice úst a střeva je běžně osídlena množstvím bakterií i plísní. Neporušené sliznice zajišťují, že tyto organismy zůstávají na povrchu sliznic a nepronikají skrze ně do krevního oběhu. Toto ale přestává platit v okamžiku poškození sliznic vlivem cytostatik, kdy dochází k tvorbě drobných vředů (aftů) na povrchu sliznic a celý stav může vyústit až do odlučování sliznic s nemožností přijímat potravu. Tomuto stavu říkáme mukositida abude o něm pojednáno dále.
Pacient podstupující onkologickou léčbu je tak ohrožen jednak vlastními bakteriemi sídlícími na jeho kůži a sliznicích, ale současně samozřejmě i infekcemi, které získá kontaktem s ostatními lidmi, kteří ani nemusí jevit klinické známky nemoci. Nejčastěji se jedná o členy rodiny, kde je kontakt nejtěsnější. Vysoké riziko infekce je ale i při pobytu v místech s vysokou kumulací lidí jako jsou kina, nákupní centra, školy atd. Přenos infekce je nejčastěji kapénkový (prskání slin, kýchání...) nebo kontaktem (polibek) či společným nádobím nebo hygienickými potřebami (ručníky, žínky).
Významným rizikovým faktorem infekceje i samotný centrální žilní katetr. Bakterie osídlující kůži v okolí katetru mohou cestovat skrze katetr přímo žilního řečiště a způsobit těžkou infekci.
Projevy infekcí:
Projevy infekce nastupují u onkologicky nemocných pacientů většinou dost rychle, někdy i v průběhu desítek minut. Nejčastější projevy jsou následující:
- horečkanad 38, 5°C nebo 3 x za sebou 38 - 38,4°C Pokud je současně přítomna neutropenie, mluvíme o febrilní neutropenii (viz výše). Horečku nemusí dítě pociťovat nepříjemně, na druhou stranu ale může být doprovázena silnou třesavkou, zimnicí, kolapsovým stavem . Pokud se některý z těchto symptomů spolu s horečkou objeví , znamená to vždy vysoké riziko infekce s těžkým průběhem a pacient musí být neprodleně dopraven do zdravotnického zařízení.
- zarudnutí, otok či bolestivost v místě centrálního žilního katétru. Znamená množení bakterií na kůži v okolí katétru a s tím i vysoké riziko vcestování bakterií do krevního oběhu. Opět je nutné v tomto případě co nejdříve uvědomit lékaře příslušného onkologického pracoviště.
- kašel nebo bolest v krku
- průjem nebo bolesti břicha
- puchýřky na rtech nebo bolestivý výsev puchýřků kdekoliv na těle (pásový opar)
- bílý, pálivý, povlak na sliznici dutiny ústní a/nebo na jazyku (moučnivka, soor)
Vzhledem k již zmíněnému riziku velmi rychlého průběhu infekce u onkologických pacientů je nutný kontakt s lékařem ihned po objevení se příznaků a pokud lékař stav vyhodnotí skutečně jako infekci, je na místě co nejrychlejší zahájení příslušné léčby. Léčba se zahajuje antibiotiky, dle stavu pacienta, tíže příznaků a aktuálního počtu leukocytů, se volí buď nitrožilní nebo v méně závažných případech tabletová forma. Před nasazením antibiotik jsou provedeny krevní odběry a stěry z kůže a sliznic k určení přítomnosti infekčního agens.
Neštovice:
Na tomto místě musíme upozornit na specifickou virovou infekci a tou jsou neštovice (varicela). Každoročně se vyskytne v České republice několik dětí podstupujících onkologickou léčbu, které jsou současně infikovány neštovicemi. Většinou k tomu dojde kontaktem se sourozencem nebo jiným dítětem, které prodělává akutní neštovice. Zdravé děti zvládnou neštovice bez komplikací, ale pro děti v onkologické léčbě může tato infekce představovat smrtelné nebezpečí. Může probíhat velmi rychle s postižením plic, mozku a selháním životně důležitých orgánů. Děti, které neštovice prodělali již před zahájením onkologické léčby, jsou v menším riziku, ale určitou formu neštovic mohou prodělat také. Před zahájením onkologické léčby testujeme všechny děti na přítomnost protilátek proti neštovicím. U dětí, které protilátky nemají (neprodělali neštovice), důrazně nabádáme rodiče,aby okamžitě hlásili jakýkoliv kontakt s neštovicemi a vůbec omezili kontakt jejich nemocného dítěte s ostatními malými dětmi , které docházejí do kolektivu. Pokud přesto ke kontaktu s neštovicemi dojde, je nutné co nejdříve zahájit preventivní léčbu specifickou protilátkou a protivirovými léky.
Nevolnost a zvracení
Příčina:
Nevolnost (nausea) a následně i zvracení jsou častým důsledkem protinádorové chemoterapie. Mohou se vyskytnout i při radioterapii na oblast mozku. Jednotlivá cytostatika se liší ve své schopnosti vyvolat nauseu a zvracení, ale v určité míře je toho schopno každé. Obtíže nastupují krátce po zahájení infuze cytostatik a mohou pokračovat i několik dní po jejím ukončení. Citlivější děti po opakované zkušenosti zvracení při chemoterapii pociťují nevolnost a mohou zvracet již před podáním chemoterapie. Zvracení u nich může vyvolat jen pohled na připravené infuze, mluvíme o tzv. předběžném zvracení. Zvracení a nevolnost patří mezi velmi nepříjemné prožitky pro každého člověka, naše pacienty nevyjímaje. U starších dětí může vést dokonce k odmítání další léčby, u všech dětí má za následek zhoršení stavu výživy.
Naší prvořadou snahou je projevům nevolnosti předcházet nebo je alespoň zmírnit a to všemi dostupnými prostředky.
Léky (antiemetika):
Léky ( antiemetika)jsou podávány před a v průběhu každé chemoterapie. Jejich dávka a frekvence závisí na typu podávaných cytostatik a také zkušenosti s každým jednotlivým pacientem, na jeho individuální náchylnosti ke zvracení. Některým pacientům podáváme léky v tabletové formě ještě domů. Antiemetik je několik druhů a jejich účinek se kombinuje. U pacientů, kteří mají tzv. předběžnou nevolnost či zvracení, podáváme zklidňující léky před chemoterapií. V případě cytostatik s velmi silným emetogenním (zvracivým) účinkem někdy ovšem ani kombinace všech léků, které máme k dispozici, zcela neodstraní pocity nevolnosti a může se objevit i zvracení.
Opatření:
Režimová opatřeníjsou neméně důležitá než léky, obzvláště tehdy, neodstraní-li - léky všechny obtíže. Prvořadým úkolem režimových opatření je neznechutit dítěti všechna jídla a i při nechutenství ho přimět ke konzumaci alespoň některých jídel a tekutin k udržení dostatečného kalorického příjmu a hydratace. Zde jsou základní doporučení:
- v období nevolnosti nenuťte dítěti jeho oblíbená jídla, můžete tím vyvolat odpor i k oblíbeným jídlům
- nabízejte malé množství lehce stravitelného jídla, opakovaně - krekry, tousty, kuře, tvrdé bonbony, pudinky, smetanové jogurty ...
- tekutiny jsou lepší chlazené, bez bublinek, ne příliš aromatické, pité brčkem. Podávejte je průběžně , po celý den
- jídlo podávejte spíše chladnější (teplé vyvolává větší nevolnost), ve větraném prostředí, bez zápachů
- po jídle nechte děti odpočívat, nejlépe vsedě
- o jídle s dítětem příliš nemluvte, snažte se respektovat jeho spontánně vyslovené chuti, nic mu nevnucujte, nevyhrožujte (když to nesníš, tak....)
- pacienti často popisují změnu chuti - dříve oblíbená jídla jim nechutnají, naopak vyhledávají jídla, která by dříve nepozřeli. Tuto změnu je nutné včas postřehnout a pokud možno respektovat.
- snažte se vypozorovat okolnosti nevolnosti či zvracení (denní dobu, léky apod.) a přizpůsobit tomu režim stravy
- snažte se, aby dítě na sobě nemělo těsné, škrtící oblečení - zvyšuje nevolnost
- v případě předběžné nevolnosti se snažte odvést pozornost dítěte od chemoterapie a nedávejte mu nic jíst 1-2 hodiny před chemoterapií. Především u starších dětí může v tomto případě pomocí psycholog, přítomný na oddělení.
Průjem
Projevy a příčina:
Průjmem označujeme stav, kdy se řídká stolice objevuje několikrát denně. U kojenců a dětí do 3 let jde vždy o závažný jev, neboť může dojít k rychlé dehydrataci organismu. Je nutné tento problém ihned hlásit lékaři. Stejně tak je nutné hlásit průjmy spojené s bolestí či křečemi břicha nebo přítomností krve ve stolici.
Příčinou průjmu bývá většinou poškození střevní sliznice chemoterapií či radioterapií, méně často stojí v pozadí infekce.
Režimová opatření:
- v případě prudkého, vodnatého průjmu podávat 12- 24 hodin pouze tekutiny - pomalu, ale po celý den - čaj mírně slazený, minerálky, vývar. Poté lze přejít na jídlo dle následujících bodů.
- jíst pomalu, malé množství jídla, ale častěji, 6- 8 x denně
- vyvarovat se jídle tučných, smažených, s vysokým obsahem cukru (coca-cola, cukrovinky), nadýmavých (fazole, brokolice, květák, hrášek), ostrých a pálivých jídel, mléka
- je dobré podávat jídla se složitými cukry a vyšším obsahem minerálů a draslíku, který se při průjmu ztrácí. Dobré jsou banány, vývar z masa, vařené brambory, rýže, nemaštěné těstoviny.
- tekutiny podávejte nadále trvale, pomalu, nejlépe brčkem
- pokud se průjem nezlepšuje a/nebo dítě zvrací, kontaktujte vždy lékaře
Zácpa
Příčiny:
Zácpa v průběhu onkologické léčby má několik příčin. Nejdůležitější roli hrají sama cytostatika, svůj podíl mají i léky proti bolesti (analgetika), změna stravy s nedostatkem vláknin a nedostatek pohybu. Zácpa sama o sobě většinou není dítětem negativně pociťovaná. Pokud nedojde k vyprázdnění po několik dní, může dítě pociťovat nevolnost, mírné bolesti břicha. Zácpa je nežádoucím stavem především z důvodu rizika nárůstu bakteriálního osídlení střeva a s tím souvisejícího rizika infekce. Proto se vždy snažíme, aby i v průběhu chemoterapie docházelo k pravidelnému vyprazdňování.
Opatření:
Základní režimová opatření:
- nabízejte dítěti pravidelně tekutiny po celý den
- snažte se nacvičit určitý stereotyp vyprazdňování vzhledem k denní době (např. vždy ráno po snídani)
- pokud dítě toleruje stravu, snažte se nabízet jídla s vyšším obsahem vlákniny - celozrnné pečivo, obilniny, jablka, hrušky, ovesné vločky... Výběr těchto jídel je však omezený vzhledem k nutnosti dodržovat především antibakteriální dietu.
- snažte se dítěti dopřát co nejvíce pohybu a to i za pobytu v nemocnici. Dítě by nemělo ležet na lůžku pokud to není nezbytně nutné vzhledem k podávané léčbě.
- omezte potraviny, které zácpu spíše podporují - čokoláda, černý čaj, banán
- pokud dítě nejde 2 - 3 dny na stolici, vždy uvědomte lékaře
Poškození sliznice dutiny ústní a krku
Příčiny:
Buňky sliznice dutiny ústní patří k rychle se množícím buňkám v lidském těle a to je také činí velmi citlivými k poškození cytostatiky a radioterapií. Za několik dní po podání chemoterapie dochází v ústech, na jazyku i v krku k bolestivému zarudnutí sliznic, tvorbě aftů a postupně až k odlučování částí sliznic. Tomuto postižení říkáme mukositida a patří mezi nejčastější komplikace onkologické léčby. Riziko vzniku mukositidy závisí jednak na použitém cytostatiku a také na individuální vnímavosti každého pacienta. Mezi cytostatika s nejvyšším rizikem vzniku mukositidy patří metotrexát, cytosar a vincristin. Po stejné dávce léku může u jednoho pacienta vzniknou jen velmi mírné zarudnutí sliznice nenarušující schopnost polykání, u jiného ale může vést až k těžké mukositidě znemožňující přijímání potravy. Svůj podíl na mukositidě má i pokles leukocytůpo chemoterapii. Maximum postižení sliznice se tak většinou kryje s okamžikem nejnižších hodnot leukocytů. Stejně tak se vzestupem leukocytů začíná hojit i mukositida.
Obtíže a rizika:
Obtíže a rizika, která mukositida nese pacientovi, jsou následující:
- bolest
- porucha příjmu potravy
- riziko infekce
Bolestjsme schopni účinně tlumit analgetiky ve formě tablet nebo v těžších případech nitrožilní aplikací. Dobrý, ale velmi krátkodobý analgetický účinek mají lokální opatření jako je cumlání kostek ledu, ledové ovocné tříště, výplachy roztoky TantumVerde nebo roztoky s lokálními anestetiky.
I při zvládnutí bolesti léky, není většinou pacient při těžké mukositidě schopen kousat a polykat. Je nutné zavést určitá opatření k zajištění alespoň minimálního příjmu stravy. V těžších případech je ale současně nutná dočasná nitrožilní výživa.
Dutina ústní je i za normálních okolností osídlena (kolonizována) bakteriemi i plísněmi. U onkologických pacientů, často pobývajících v nemocnici mohou navíc tyto bakterie být rezistentní na běžná antibiotika a tím získávají na nebezpečnosti. V okamžiku postižení dutiny ústní mukositidou se bakterie i plísně snadno dostávají do krevního oběhu a působí závažné infekce (sepse). Proto pacienti s mukositidou a současnou teplotou patří mezi velmi rizikové a většinou jsou jim rychle nasazována nitrožilní antibiotika.
Snížení rizika infekce v dutině ústní:
Ke snížení rizika infekcí v dutině ústní je dobré zachovávat po celou dobu léčby několik základních režimových doporučení:
- po celou dobu onkologické léčby dbát o dobrou hygienu dutiny ústní. Zuby čistit po každém hlavním jídle měkkým kartáčkem, dle zvyklostí a schopností dítěte lze užít i mezizubní kartáček nebo interdentální nit. Zubní kartáček po použití vždy dobře vyčistěte a uchovávejte na suchém místě. Používejte zubní pasty s neutrálním pH.
- ústa lze vyplachovat roztokem s bikarbonátem (l/2 kávové lžičky sody bikarbony) s 250 ml vody. Nevhodné jsou ústní vody s obsahem alkoholu.
- po dobu chemoterapie je třeba přerušit používání zubních rovnátek, stejně nevhodný je jakýkoliv piercing v dutině ústí nebo na rtech
- jakékoliv stomatologické zásahy v dutině ústní vždy konzultujte s ošetřujícím lékařem na onkologii
Postup při již vzniklé mukositidě:
V době již vzniklé mukositidy a případně současné trombocytopenie a neutropenie:
- místo zubního kartáčku a pasty používejte k čistění dutiny ústní tampony namočené v roztoku sody bikarbony. Použít se dá i roztok Tantum Verde nebo 0,1% chlorhexidinový roztok.
- snažte se co nejčastěji vyplachovat ústa. Čím těžší je mukositida a větší neschopnost jíst, tím větší význam mají časté výplachy (několikrát za hodinu) pro hygienu dutiny ústní. K častým výplachům je ideální roztok sody bikarbony nebo Tantum verde. Chlorhexidin může při těžší mukositidě způsobovat pálení sliznic. Někteří rodiče mají velmi dobrou zkušenost se slabým odvarem šalvěje. Opatrnost je nutná u malých dětí, které mohou roztok polykat a ne vyplivovat, což by při velkém objemu výplachů mohlo vést ke zvracení.
- genciánovou violeť (fialový roztok) používejte jen velmi opatrně a až po doporučení lékaře. Má desinfekční účinky, ale současně i tendenci sliznice příliš vysušovat a při neopatrném dávkování může paradoxně poškození sliznic zhoršit. Ideálně by měla být podávána po jedné kapce do úst l -2 x denně.
Z jídeljsou v této době samozřejmě nejlépe tolerovaná měkká jídla, jako jsou omáčky, pudinky, knedlíky, kaše, mleté maso, banány, vodové nanuky, kompoty. Nevhodná jsou jídla příliš teplá a dráždivá (kyselé, kořeněné) a jídla s vysokým rizikem infekce (plísňové sýry, živé jogurtové kultury, oříšky, sušené ovoce). Nakonec ale stejně většinou respektujeme přání dítěte neboť fakt, že vůbec chce něco jíst, je ze všeho nejdůležitější.
Nežádoucí účinky chemoterapie na vlasy a kůži
Dočasná ztráta vlasů:
Dočasná ztráta vlasů (alopecie)je obecně nejznámější a také nejčastější následek chemoterapie. Přestože ztráta vlasů s sebou nenese žádné zdravotní riziko a vlasy po chemoterapii vždy narostou, je tato skutečnost pro rodiče i pacienty na samém počátku léčby často vnímána jako velmi devastující. Ovšem podle naší zkušenosti se, po počátečním pochopitelném šoku, pacient i rodiče s alopecií vyrovnávají velmi dobře a rozhodně ji nestaví do popředí svých stesků. Stává se, že po mírnější chemoterapii nemusí vlasy vypadat vůbec, naopak po vysokodávkované chemoterapii dochází k dočasnému vypadání obočí a řas.
Výpad vlasů může vyvolat i radioterapie. Po radioterapii je nárůst vlasů opožděný a někdy při vyšších dávkách může dojít k trvalé ztrátě vlasů v rozsahu ozařovaného pole (nikdy ne na celé hlavě).
Vliv na kůži:
Kůžeje dobrým ukazatelem zdraví organismu a není divu, že v průběhu chemoterapie trpí. Většina pacientů má sklon ke zvýšené suchosti kůže, někdy s opakovanými svědivými ložisky ekzému. Kůže je náchylnější k bakteriálním zánětům a to především v místě nehtových lůžek. Na místě je opatrnost při stříhání nehtů a vyvarovat se zlozvyku okusování nehtů. Zvýšená lomivost nehtů, jejich roztřepení a změna zabarvení je častým průvodním jevem léčby. K péči o kůži se osvědčují nedráždivé, neparfémované krémy (ung. leniens, Infadolan, Excipial Lipolotio...).
Zvýšená pigmentace(zhnědnutí kůže) je důsledkem léčby některými cytostatiky. Pigmentace přetrvává i několik měsíců po ukončení léčby a mizí tak, jak se postupně vrchní část kůže olupuje a je nahrazována novou vrstvou.
Vlivem chemoterapie může být kůže více citlivá na působení slunečního záření. Obecně tak nedoporučujeme pro pacienty v aktivní léčbě pobyt na přímém slunci, na osluněné části těla doporučujeme ochranný krém s faktorem 15.
Nežádoucí účinek chemoterapie na nervovou soustavu
Příčiny a projevy:
Některá cytostatika poškozují periferní nervy a způsobují jejich dočasnou poruchu funkce (neuropatie). Tímto nežádoucím účinkem jsou známa především často používaná cytostatika ze skupiny vinca alkaloidů (Vincristin, Vinblastin). Prvním projevem poškození nervů bývá mravenčení v prstech horních končetin s poruchou jemných pohybů. Dítě začne být neohrabané, neudrží v ruce hrneček, pastelky. Malé děti mravenčení nazývají bolestí. Někdy současně, a někdy až poté, se objevují stejné obtíže na ploskách nohou spolu se zvláštní poruchou chůze, kdy dítě zvedá při kroku nohy vysoko nad podložku.
Nejtěžším a velmi závažným projevem poruchy periferních nervů je porucha nervů ve stěně střevní s těžkou zácpu se zástavou střevního pohybu (paralytický ileus). Vzácněji může dojít i k akutní zástavě močení z důvodu poruchy nervů ve stěně močového měchýře. Poslední dvě zmíněné komplikace jsou většinou vždy předcházeny poruchami citlivosti rukou a nohou. Proto vždy chceme po pacientech, aby včas nahlásili jakékoliv podobné obtíže, tak abychom mohli popřípadě upravit dávku cytostatik. Veškeré, i velmi těžké, výše uvedené komplikace jsou dočasné a po vysazení léky v průběhu několika týdnů mizí.
Nežádoucí účinky chemoterapie na pohlavní ústrojí a plodnost
Vliv chemoterapie:
Chemoterapie může, i když ne vždy, působit na funkci pohlavních orgánů. Definitivní funkční důsledek závisí na pohlaví dítěte, na jeho stáří a stadiu pubertálního vývoje v době působení chemoterapie a samozřejmě na typu použitého cytostatika.
Chlapci:
Chemoterapie může snižovat počet spermií a způsobuje další abnormality, které mohou být příčinou trvalé nebo dočasné neplodnosti.
U chlapců před začátkem puberty, tj. do 10. – 12. roku věku, jsou zárodečné buňky relativně chráněny před účinkem chemoterapie. Radioterapie na oblast varlat však spolehlivě ztrátu plodnosti způsobí. Důsledkem je mimo neplodnosti i porucha sekrece mužského pohlavního hormonu testosteronu a narušení normálního průběhu puberty. V tomto případě musí být pacient sledován endokrinologem a včas musí být zahájena substituční léčba příslušným hormonem.
U chlapců po nástupu puberty je poškození spermií velmi pravděpodobné. Těmto chlapcům je nabídnuta možnost zamražení spermií před zahájením chemoterapie k umožnění tzv. umělého oplodnění v době, kdy budou chtít založit rodinu a jejich spermie budou po léčbě již poškozeny. Spermie se získají odběrem ejakulátu masturbací.
Dívky:
Do začátku puberty (před nástupem první menstruace) jsou dívčí pohlavní orgány (vaječníky) chráněny před účinkem chemoterapie. Chemoterapie před nástupem puberty tedy nevede ke snížení plodnosti dívky. Opět je však jedinou vyjímkou radioterapie na oblast malé pánve, kde vaječníky mohou být zasaženy. Pokud je to možné, vždy se snažíme ozařované pole zaměřit mimo vaječníky. Druhou, složitější možností ochrany vaječníků při radioterapii, je dočasná změny polohy vaječníků v pánvi pomocí chirurgického zákroku. Stejně jako chlapců, pokud jsou vaječníky v důsledku radioetrapie nefunkční, je nutná péče endokrinologa a včasná substituce chybějících hormonů k zahájení normálního průběhu puberty.
Dívky po nástupu menstruace jsou stejně jako chlapci ve vysokém riziku trvalého poškození funkce vaječníků a následné neplodnosti v důsledku chemoterapie. V posledních několika letech byl vyvinut a je s úspěchem používán postup tzv. hormonální ochrany gonád. Před zahájením chemoterapie jsou vaječníky hormonálně uvedeny do klidového, prepubertálního stavu a tím jsou v průběhu léčby chráněny před účinky chemoterapie. Po dokončení chemoterapie a vysazení hormonální blokády dívky začínají opět normálně menstruovat a jejich plodnost je zachována.
Ochrana:
Naším cílem je, se u každého pacienta pokusit o nějaký způsob ochrany reprodukčních funkcí. Každý pacient a jeho rodiče jsou před zahájením chemoterapie informováni o konkrétním riziku s ohledem na plánovaný způsob léčby, věk a pohlaví pacienta a je jim navrhnut odpovídající způsob ochrany funkce pohlavních orgánů.
Nežádoucí účinky kortikoidů – Predisonu a Dexamethasonu
Prednison a dexamethason:
Prednison a dexamethason jsou léky velmi často užívané v onkologii, především v léčbě lymfomů a leukemií. Tyto léky obsahují tzv. steroidní hormony běžně produkované v těle každého člověka. Léková forma ale obsahuje mnohonásobně vyšší množství hormonu, který má zcela specifický účinek na nádorové buňky, především na lymfocyty. V léčbě nemocí způsobených nekontrolovatelným množením patologických lymfocytů, jako jsou některé leukemie a lymfomy, mají prednison a dexamethason klíčovou roli a nelze se bez nich v léčbě obejít.
Nežádoucí účinky:
Mnohonásobně navýšené množství těchto látek v těle má za následek i nežádoucí účinky, se kterými se nesetkáme u cytostatik.
Jedná se především o:
- poruchu hospodaření se solí a vodou. Následkem je přírůstek na váze, typicky nejvíce viditelný na trupu a obličeji.
- zvýšená chuť k jídlu. Přispívá k přírůstku na váze.
- dráždění žaludeční sliznice. K lékům pacient automaticky dostává přípravek na snížení kyselosti žaludku a ochranu sliznice.
- ochablost svalů. Spolu s přírůstkem na váze může svalová slabost vést především u malých dětí k dočasné neschopnosti chůze.
- zvýšení hladiny krevního cukru. U menšiny dětí může dojít až k rozvoji dočasné cukrovky s nutností podávání inzulinu.
- snížení pevnosti kůže. Především u adolescentů při současném příbytku na váze může dojít až k tvorbě tzv. pajizévek (striae). Jedná o poruchu pouze kosmetickou.
- zvýšení krevního tlaku
- zvýšené ztráty draslíku močí s jeho chyběním v organismu. Draslík pacientům dodáváme ve formě tablet.
- podrážděnost, nespavost
Režimová opatření:
Pro pacienta resp. jeho rodiče z výše uvedeného vyplývají určitá režimová opatření, která je dobré dodržovat v průběhu užívání dexamethasonu a prednisonu.
- vyhýbat se sladkým jídlům, při zvýšené chuti k jídlu se vyhýbat jídlům tučným a nadýmavým
- jíst častěji, ale po malých dávkách. Na noc jsou s výhodou mléčné výrobky (smetanový jogurt).
- léky užívat po jídle
Lékařem je pravidelně kontrolován krevní tlak, hladina cukru v moči a krvi, hladina draslíku.
Změny psychického stavu:
Zvláštní neurologickou poruchou jsou změny psychického stavu způsobené kortikoidy. Děti jsou zvýšeně dráždivé, mají rychlé změny nálad, jsou agresivní vůči rodičům, mají spíše tendence ke smutku. Vzácně u větších dětí a adolescentů může dojít až k rozvoji psychosy s depresivními, manickými či schizofrenními rysy. V tomto okamžiku je dítě svým chováním samo sobě nebezpečné a je nutná psychiatrická léčba.
Rodičům především malých dětí lze doporučit, aby se ve fázi léčby kortikoidy obrnili trpělivostí a respektovali náladovost dítěte, které za to v podstatě nemůže. Jsme si vědomi, že je to velmi náročné období pro celou rodinu a spolupráce s naším psychologembývá prospěšná.
Vysazení léků:
Prakticky všechny vedlejší účinky (až na pajizévky) jsou dočasné a do několika týdnů po vysazení léků mizí. Pokud se ale léky užívají déle než 5 dní je nebezpečné ukončit jejich užívaní naráz, ale vysazují se postupně v průběhu 1 – 2 týdnů.
Dexamethason a prednison nepůsobí zvracení, snížení počtu krvinek ani mukositidu.
Režim dítěte
"Co máme doma dělat jinak než dosud ?"
Tak zní obvyklá otázka rodičů, kteří jsou poprvé propuštěni z nemocnice po stanovaní diagnózy a zahájení léčby. Obvykle vystrašení, dosud ne zcela srovnaní s převratem v životě, s obavou z neznámého.
Pokusíme se vysvětlit nejenom co je nutné dělat jinak, ale především PROČ. Pokud rodiče a i jejich dítě pochopí podstatu toho, co se děje, zbaví se zbytečného strachu a ulehčí si život s nemocí .
Porucha obranyschopnosti pacienta:
Po celou dobu léčby a i několik měsíců po jejím ukončení patří děti s onkologickým onemocněním mezi jedince s vysokým rizikem závažných infekcí. Toto riziko ještě vzrůstá při poklesu počtu bílých krvinek (neutrofilů)pod kritickou mez 500/ul. Největší riziko infekce pro dítě znamená především kontakt s ostatními lidmi, potraviny obsahující plísně či bakterie a očkování.
JAK SE CHOVAT:
A:Omezit pobyt dítěte v kolektivu lidí. V žádném případě nedoporučujeme školní či školkovu docházku v době aktivní léčby. Většina dětí je ale schopná zvládat individuální školní výuku. Taktéž zcela nevhodné jsou návštěvy kin, divadel, nákupních center a cestování hromadnými dopravními prostředky. V rodině je vhodné omezovat počet návštěv na nejbližší příbuzné, na které je dítě zvyklé, a členy rodiny s akutním onemocněním k dítěti nepouštět.
B:V dietě po celou dobu léčby vyloučit potraviny s vysokým rizikem plísní a bakterií, v době těžké neutropenie i čerstvé ovoce a tepelně neupravenou stravu. Pomůckou vám může být seznam rizikových potravin. Další úpravy diety doporučuje ošetřující lékař dle aktuálního zdravotního stavu dítěte.
C:Po celou dobu léčby nesmí být dítě očkováno jakoukoliv vakcínou. Sourozenci dětí by neměli být očkováni vakcínami s obsahem živých zárodků nemoci (dětská obrna , tbc ). Po ukončení onkologické léčby u všech dětí, ve spolupráci s infekční klinikou, provádíme kontrolu protilátek a doočkování.
D:Zvířata, která v rodině, žijí není nutné "dávat pryč", jen není vhodné aby se s nimi dítě mazlilo a přicházelo do styku s výkaly či slinami.
E:V bytě není nutné provádět speciální dezinfekci nebo čištění vzduchu. V bytě by pouze neměly probíhat stavební práce, při kterých se prudce zvyšuje množství plísní v ovzduší.
F:Pobyt dítěte venku je doporučován. Pokud se dítě cítí dobře není nutné jej omezovat. Samozřejmě za podmínek uvedených výše.
Snížení počtu krevních destiček (trombocytopenie):
Dochází k němu opakovaně v důsledku poškození krvetvorby cytostatiky. Důsledkem je krvácení,které je přímo úměrné počtu trombocytů. V době propuštění jsou rodiče vždy upozorněni na aktuální počet destiček a případné riziko krvácení. Pokud si myslíme, že se dá očekávat prudký významný pokles trombocytů, vždy zveme pacienta časně na kontrolu krevního obrazu.
JAK SE CHOVAT:
A:Zcela jednoduše omezit riziko úrazu dítěte. Zejména u malých dětí nedoporučujeme jízdu na kole, sáňkování, lyžování.
B:V případě úrazu či krvácení kontaktovat lékaře v místě bydliště (pohotovost).
Centrální žilní katetr:
Naprostá většina dětí má zavedený CVK pro snadnější aplikaci léků a odběrů krve. Katetry jsou konstruovány pro dlouhodobé zavedení a je předpoklad, že dítě s nimi bude pobývat doma a bude přitom normálně aktivní. Případné samovolné či násilné vypadnutí katetru může způsobit krvácení z podkoží. K závažnějšímu krvácení může dojít pouze tehdy je-li s katetrem manipulováno a je otevřeno jeho ústí. Dle našich zkušeností však k této situaci doma nedochází, neboť katetry jsou před propuštěním zabezpečeny a navíc si děti si na katetr zvyknou a doma si ho nevšímají. Riziko infekce katetru v domácích podmínkách a při běžné hygieně je velmi nízké.
JAK SE CHOVAT:
A:Katetru si doma všímat co nejméně, nerozbalovat koncovky. S katetrem smí manipulovat pouze personál zdravotnických zařízení, který s tím ma zkušenost, což jsou pouze větší nemocnice.
B:Tunelizovaný katetr (Hickman), kde jsou koncovky volně vyvedeny na hrudník by měl být chráněn před vodou. Dětem tak doporučujeme pouze sprchování, nikoliv koupání, kdy by se katetr dostal pod vodu. Místo na kůži, kde je katetr vyveden z těla, většinou sterilně kryjeme, ale při dobrém stavu a zhojené ráně může zůstat i bez krytí.
C:Katetr typu Porth-a-Cath, který je kompletně kryt kůží umožňuje dětem při dobře zhojené ráně i koupání. Nevyžaduje žádné krytí rány a není zde riziko spontánního vypadnutí.
D:Pokud dítě za pobytu doma udává náhle bolesti v oblasti katetru, kůže v okolí je více zarudlá či je patrný otok končetiny na straně zavedení katetru, vždy kontaktujte lékaře KDO.
Speciální onkologie
- Ewingův sarkom ES >>>>
- Germinální nádory GCT >>>>
- Hemangiomy HAG >>>>
- Histiocytosa z Langerhansových buněk LCH >>>>
- Maligní lymfom (maligní lymfogranulom, morbus Hodgkin) HD >>>>
- Akutní leukémie ALL >>>>
- Nádory jater – hepatoblastom HB >>>>
- Nehodgkinské lymfomy (NHL) >>>>
- Neuroblastom NBL >>>>
- Osteosarkom OS >>>>
- Retinoblastom RB >>>>
- Sarkomy měkkých tkání STT >>>>
- Tumory centrální nervové soustavy – muzku a míchy CNS >>>>
- Tumory ledvin – nefroblastom (Wilmsův nádor) WT >>>>
- Autologní transplantace a kmenových buněk krvetvorby ASCT >>>>
Ewingův sarkom
Definice:
Jedná se o nádor vycházející z primitivních buněk parasympatického nervového sytému. Jeho zralejší forma se nazývá primitivní neuroektodermální nádor (PNET).
Výskyt:
Ewingův sarkom (ES) tvoří asi 4% všech nádorů dětí a dospívajících. Onemocnění je vzácné u dětí pod 5 let, vrchol výskytu je mezi 10. a 15. rokem.
Pro tento typ nádoru je charakteristická specifická cytogenetická abnormita, která je detekovatelná v nádoru a pomáhá v odhalování tzv. minimální nemoci v kostní dřeni.
Nejčastější lokalizací ES jsou pánevní kosti nebo kosti stehenní a holenní. Asi třetina pacientů má postižené pouze měkké tkáně.
Nádor časně metastazuje do plic, kostní dřeně a lymfatických uzlin.
Příznaky:
Nádor se projeví zduřením a bolestí příslušné oblasti. Při lokalizaci nádoru v oblasti pánve mohou být bolesti někdy lokalizovány do kolene a pacient je dlouhou dobu sledován na ortopedii než je odhalena správná diagnóza. Růst nádoru bývá doprovázen horečkou a hubnutím.
Diagnostika:
Na prostém rtg snímku je většina kostních tumorů jasně viditelná, k přesnější diagnostice slouží NMR. K diagnostice mimokostních tumorů slouží ultrazvuk a opět NMR. Vzhledem k časnému a rozsáhlému metastazování je v případě ES velmi důležité vstupní kompletní vyšetření včetně CT plic, vyšetření kostní dřeně, scintigrafie kostí a PET vyšetření.
K definitivnímu určení typu nádoru je nutný odběr vzorku tkáně z tumoru a jeho histologické vyšetření. Radikální operace se na začátku onemocnění, při diagnóze, neprovádí.
Léčba:
Léčba ES je komplexní a zahrnuje všechny tři základní léčebné modality. Na úvod po diagnóze se zahajuje intenzivní chemoterapie s cílem zmenšit a ohraničit nádor. Po několika týdnech chemoterapie následuje pokus o radikální operaci. Po operaci je nutná opět chemoterapie a, v případě neúplně odstraněných tumorů, i radioterapie na oblast zbytku tumoru. U vysoce rizikových pacientů má svou úlohu v léčbě i autologní transplantace kmenových buněk. Léčba ES v ČR v současné době probíhá dle evropského léčebného protokolu EuroEwing 99.
Léčebné výsledky:
Pacienti s iniciálně lokalizovaným onemocněním, které umožňuje radikální chirurgické řešení, mají prognózu dobrou a v současné době je jich až 80% vyléčeno. S rozsáhlým onemocněním, které neumožňuje radikální odstranění nádoru, se šance na vyléčení zmenšuje a dosahuje 40%. Bohužel stále velmi nízkou šanci na přežití mají pacienti s metastatickým onemocněním při diagnóze.
Germinální nádory
Definice:
Germinální nádory vznikají z různých typů zárodečných buněk, histologicky se jedná o značně heterogenní skupinu buněk.
Výskyt:
Tvoří přibližně 3% všech dětských nádorů. Častější jsou u dětí s vrozenými genetickými syndromy (Klinefelterův syndrom, syndrom gonadální dysgeneze). U chlapců je onemocnění častější mezi první a čtvrtým rokem, u dívek v období 10-14 let.
Histologie a i biologické chování germinálních tumorů je velmi rozdílné. Může se jednat o nádory ze zralých buněk, které dále nerostou a nechovají se zhoubně, tzv. zralé teratomy. Jsou zde ale i nádory z nezralých zárodečných buněk, které velmi rychle rostou a metastazují, např. dysgerminom a nádory ze žloutkového váčku.
Lokalizace nádorů je primárně nejčastější v pohlavních žlázách – vaječníky, varlata. Mohou však být lokalizovány i mimo tyto oblasti, nejčastěji v oblasti centrální nervové soustavy. Pro novorozence je typický tzv. sakrokokcygeální teratom. Vrozený tumor, který je lokalizován v oblasti kostrče, může dosahovat i značných rozměrů. Chování je nepředvídatelné, může v průběhu kojeneckého věku i malignizovat.
Germinální nádory metastazují především do plic, lymfatických uzlin a mozku.
Příznaky:
Závisí na lokalizaci onemocnění. Při postižení vaječníků bývá často prvním příznakem až zvětšování a bolest břicha při značně velkém tumoru. Nádory varlat na sebe poměrně brzy upozorní tuhým nebolestivým zvětšením varlete. I tak se ale často diagnostikují pozdě, kvůli studu chlapců, kteří se svým problémem včas nesvěří. Jak u varlat, tak u vaječníků může dojít na podkladě i malého tumoru k tzv. torzi (přetočení) příslušného orgánu a tím přerušení cévního zásobení. Projevem je náhlá, krutá bolest a stav vyžaduje okamžité chirurgické řešení.
Sakrokokcygeální nádory jsou u novorozence v oblasti kostrče většinou jasně patrné. Nádory vyrůstající podél páteře v hrudníku se projeví kašlem a obtížným dýcháním.
Nádory mohou být hormonálně aktivní a časným projevem nádorů může být nástup předčasné puberty, zvýšené ochlupení, zhrubění hlasu atd.
Diagnostika:
K určení rozsahu onemocnění se provádí ultrazvuk, CT či NMR příslušné oblasti a scintigrafie kostí. Vždy se provádí vyšetření hormonů a proteinů, které germinální tumory mohou produkovat, tak aby se dala případně sledovat aktivita nemoci v průběhu léčby a po ní. Histologie nádoru je zásadní pro správné nastavení léčby.
Léčba:
Pro nádory, které jsou histologicky benigní (teratomy, sakrokokcygeální teratomy) je primárně v léčbě užíváno pouze operace a pacient je dále pouze sledován. Nádory, jejichž povaha je maligní, jsou léčeny intenzivní chemoterapií, v indikovaných případech i s použitím autologní transplantace kmenových buněk. Radioterapie má v léčbě velmi omezený význam a je rezervována pouze pro tumory, které neustoupily po chemoterapii a nelze je řešit chirurgicky.
Léčebné výsledky:
V současné době se daří zachránit asi 90% dětí s lokalizovaným onemocněním a přibližně 7% dětí s pokročilým onemocněním v době diagnózy.
Hemangiomy
Definice:
Nezhoubné nádory z krevních cév.
Výskyt:
Typický pro výskyt těchto nezhoubných nádorů je novorozenecký a kojenecký věk. Jedná se sice o nádory svým charakterem nezhoubné, přesto ale mohou významně dítě poškodit či ohrozit na životě v závislosti na lokalizaci růstu hemangiomu.
Hemangiomy se rozdělují jednak podle histologie a dále podle charaketru růstu. Nejčastější lokalizací hemangiomů je obličej. U dětí se téměř vždy jedná o vrozené nádory, zdaleka ne všechny však musí být patrné již při narození. Klinicky podstatné je především dělení podle charakteru růstu. Může jít o vrozený hemangiom spontánně involující a hemangiom rychle rostoucí, neinvolující. Samostatnou jednotku tvoří tzv. hemangiomatóza s mnohočetným postižením kůže a často i vnitřních orgánů. Důležitá je i lokalizace hemangiomu na kůži, dle které lze usuzovat na možné riziko postižení vnitřních orgánů jako jsou dýchací cesty, játra, mozek.
Příznaky:
Odvíjejí se od charakteru růstu hemangiomu a jeho lokalizace. Vrozený, rychle rostoucí hemangiom je patrný při narození pouze jako drobná tmavě červená skvrna a v následujících týdnech velmi prudce roste a mimo kosmetického defektu může významně ohrožovat orgány v okolí, např. dýchací cesty, oči, dutinu ústní atd. K lékaři většinou rodiče přivádí samotný hemangiom, který je velmi nápadný. Další typ hemangiomu je založený již při narození, je většinou malý a dále v podstatě kopíruje růst dítěte. Tyto hemangiomy nebývají při narození nijak nápadné, jsou uloženy hlouběji v podkoží, nebolestivé a mohou být na první pohled mylně považovány za nádor. Diagnostikovány jsou většinou až v batolecím a předškolním věku. Třetím typem hemangiomy, které jsou plně vytvořeny při narození, mohou dosahovat i značné velikosti a již při narození působí obtíže-nejčastěji dechové nebo polykací.
Pokud hemangiom postihne játra , projeví se většinou nárůstem velikosti břicha, zvýšenou únavou dítěte a neprospíváním. Na kůži přitom mohou být jen velmi drobné hemangiomy.
Prvním příznakem rozsáhlého hemangiomu vnitřních orgánů může být i krvácení při poruše krevní srážlivosti, kterou určité typy hemangiomů mohou vzácně způsobovat.
Diagnostika:
Diagnostika rychle rostoucích hemangiomů a hemangiomů, které jsou jasně viditelné při narození je poměrně jednoduchá pomocí ultrazvuku, případně NMR. Málokdy je nutná biopsie s histologickým vyšetřením, je zde navíc i riziko krvácení při tomto výkonu. U každého kožního hemangiomu se provádí i vyšetření vnitřních orgánů a mozku k odhalení případných skrytých hemangiomů.
Léčba:
Zvláštností hemangiomů je jejich vysoká tendence ke spontánní zástavě růstu a postupnému mizení. Proto se část hemangiomů, které neohrožují funkci orgánů, nehrozí těžkým trvalým kosmetickým defektem nebo nejsou infikované vůbec neléčí. Hemangiom, který začne prudce růst časně po narození, většinou kolem 6. měsíce života růst přestává a dále po jednom roce začíná mizet. Je pravdou, že úplné zmizení hemangiomu se dá očekávat často až kolem desátého roku života.
Léčba se navrhuje pro ty děti, jejichž hemangiomy zhoršují funkce orgánů (poruchy dýchání, zraku, polykání...) nebo hrozí značným kosmetickým defektem i po spontánním ústupu. Léčba se zahajuje kortikoidy ve vysoké dávce, která se dle účinku postupně snižuje. Celková doba léčby kortikoidy je většinou několik měsíců. Hemangiomy, které nereagují na léčbu kortikoidy a ohrožují životní funkce jsou indikovány k léčbě interferonem alfa nebo cytostatiky.
Chirurgická léčba se používá spíše k odstranění zbytkového hemangiomu po jeho zmenšení. Zůstává také jediným způsobem léčby hemangiomů, které rostou pomalu spolu s dítětem a jsou diagnostikovány v pozdějším věku. Tyto typy hemangiomů většinou nereagují na léčbu kortikoidy ani jinými léky.
K odstranění případných jizev a zbytkových hemangiomů v pozdějším věku je vhodnou metodou laser.
Léčebné výsledky:
Hemangiom bývá jen velmi vzácně příčinou smrti dítěte, jedná se o nezhoubné nádory. Důležitější jsou spíše pozdní následky hemangiomů, jako jsou deformity dané části těla a jizvy. Prevencí tohoto postižení může být včasná léčba hemangiomů, často ale nelze dopředu odhadnout jaké hemangiom zanechá následky a zda léčba není pro dítě větším nebezpečím než případná jizva.
Histiocytosa z Langerhansových buněk
Úvod, patofyziologie:
Histiocytosa z Langerhansových buněk (LCH)je vzácné onemocnění, které postihuje děti i dospělé. V dětském věku však má své zvláštnosti. Nemoc se vyskytuje v dětském věku s frekvencí.
Podstatou choroby je nekontrolovatelné bujení tzv. Langerhansových buněk. Tyto buňky mají svůj původ v kostní dřeni a za normálních okolností se vyskytují v kůži, uzlinách, thymu (brzlíku) a plicích. Z dosud nevyjasněných příčin dokáží změnit své vlastnosti a pronikají do jiných orgánů, kde se nekontrolovatelně množí, což vede k poškození těchto orgánů. Jasná příčina vedoucí k tomuto chování Langerhansových buněk není známa. Vzhledem k tomu, že v mnoha případech nemoc dokáže samovolně ustoupit, se nejpravděpodobnější variantou zdá porucha imunoregulace organismu, za kterou může stát například infekce viry. Dosud ale nebyla jasně definována žádná konkrétní infekce, která by mohla působit LCH. LCH je svým způsobem unikátní chorobou v onkologii, neboť přesto, že na podkladě genetických studií se jedná o onemocnění klonální, tedy maligní, v mnoha případech se dokáže samovolně zhojit. V mnoha dalších případech však může být zcela rezistentní na chemoterapii a vede ke smrti.
Rozdělení LCH do skupin dle klinického průběhu:
A: Izolované postižení jednoho systému
Do skupiny patří asi 80% všech LCH.
Patologické buňky nacházejí pouze v jednom systému a to nejčastěji v kůži, kostech, plicích, na sliznici urogenitálního traktu či v uzlinách.
Nejrozšířenější variantou je izolované postižení kůže. Postihuje především kojence a batolata a často velmi připomíná tzv. seborhoickou dermatitidu - velmi časté a zcela neškodné onemocnění kůže kojenců s tvorbou žlutavých mastných šupin na červené kůži, postihující vlasatou část hlavy. V případě LCH je ale toto postižení velmi urputné, nehojící se po běžných přípravcích, postihuje i zvukovody a kůži trupu. Kožní postižení může být jedinou manifestací nemoci, ale také může být součástí rozsáhlejšího orgánového postižení (viz níže).
Druhým, nejčastěji postiženým místem, jsou kosti. Postižení se projeví většinou málo bolestivým otokem. Při postižení lebky se setkáváme s postupným nárůstem nebolestivé boule, kterému často předcházel drobný úraz.
B: Mnohočetné postižení kostí
Tato kategorie je v rámci LCH poměrně nová a její význam tkví v odlišném léčebném přístupu od dětí, které mají postižení kostí pouze v jednom místě. Děti s mnohočetným kostním postižením mají vyšší riziko návratu choroby a léčba je tomu uzpůsobena.
C: Systémové postižení bez poruchy funkce orgánů
Těžší forma choroby, kdy je postiženo současně dva a více systémů. Může se jednat o současné postižení kůže, uzlin, kostí, plic, jater, sleziny, kostní dřeně, střeva, mozku, atd. Pacienti s postižením plic, jater, sleziny nebo kostní dřeně patří v rámci této skupiny mezi pacienty ohrožené rychlým a nepříznivým průběhem choroby.
D: Systémové postižení s poruchou funkce orgánů
Na rozdíl od skupiny C jsou zde splněna kriteria signalizující již významnou poruchu funkce jednoho z tzv. rizikových orgánů, tedy plic, jater, kostní dřeně. Do této skupiny naštěstí spadá jen minimum pacientů, ale pokud je choroba v tomto stadiu, šance na vyléčení jsou i v současné době velmi malé.
Zvláštností LCH je postižení tzv. žíznivkou (diabetes insipidus). Pacient v tomto případě ztrácí močí velké množství tekutin a proto i více pije. Denně tak může vymočit a současně vypít až 5-8 l tekutin. Toto postižení se většinou objevuje současně se systémovým postižením.
Diagnostika LCH:
K diagnóze je nutný odběr vzorku postižené tkáně tzv. biopsie. Histologické vyšetření tkáně dá odpověď na otázku, zda-li postižení je LCH nebo ne. V době diagnózy je nutné pacienta podrobně celkově vyšetřit k určení rozsahu onemocnění a zařazení do některé z výše uvedených skupin.
Léčba a prognóza LCH:
Léčba LCH se vždy odvíjí od úrovně vstupního postižení.
Skupina A:
Pro tyto pacienty je v naprosté většině případů dostačující pouze chirurgické odstranění ložiska, u kostního postižení může stačit pouze biopsie. Kostní léze se poté spontánně zhojí. V případě rozsáhlejšího kožního postižení lze aplikovat masti na bazi kortikoidů či cytostatik. Standardně nejsou tito pacienti indikováni k celkové léčby cytostatiky. Jen malá část pacientů v této skupině prodělá návrat nemoci ve stejné či jiné lokalizaci nebo se onemocnění rozšíří na jiný orgán. Potom je léčba již nutná. V omezené míře lze v této skupině užít radioterapii na postižené místo.
Skupina B:
Pacienti s mnohočetným kostním postižením jsou v České republice léčeni dle mezinárodního protokolu vedeného Histiocytární společností. Současně platný protokol má název LCH III a pro pacienty skupiny B znamená intenzivní 6 týdenní léčbu kombinací steroidů a cytostatika Vinblastinu. Následuje 6 měsíční, málo intenzivní, udržovací léčba, jejímž cílem je minimalizovat riziko návratu nemoci.
Skupina C:
LCH se systémovým postižením je již velmi závažné onemocnění, které obzvláště v případě současného postižení některého z rizikových orgánů ( plíce, kostní dřeň, játra) nebo u dětí pod 3 roky rychle progreduje a navíc je často rezistentní na cytostatickou léčbu. Dle protokolu LCH III dostávají všichni tito pacienti úvodní 6 týdenní léčbu se steroidy a cytostatiky Vinblastinem a VP 16 s následnou 6 měsíční udržovací léčbou. Pacientům nedobře reagujícím na tuto léčby je k dispozici protokol LCH - S 2005 využívající silně imunosupresivně působící purinová analoga. Bohužel podstatná část dětí na léčbu nereaguje dostatečně, návraty nemoci jsou časté a 5 leté přežití se pohybuje okolo 80%.
Skupina D:
Jedná se o pacienty, nejčastěji kojence a batolata, kteří mají rychle progredující chorobu, bohužel často rezistentní na léčbu. Léčba je v podstatě stejná jako u skupiny C, ale její výsledky podstatně horší. V současné době stále dlouhodobě přežívá pouze 20-30% pacientů.
Právě pro posledně jmenovanou skupinu je snaha najít nové způsoby terapie, které by zvrátili zatím nepříznivé výsledky léčby. Sem se řadí alogenní transplantace kostní dřeně, imunosupresivní léčba, anticytokinové protilátky atd. I přes dílčí úspěchy se ani jeden z těchto postupů zatím nezařadil mezi standardní.
Pacienti po prodělané léčbě pro LCH zůstávají v dispenzární péči onkologické ambulance. Cílem této následné péče je, jednak včas rozpoznat případný návrat nemoci a dále diagnostikovat a léčit pozdní následky nemoci a léčby. Specifickým pozdním následkem systémové formy LCH bývá právě výše zmiňovaný diabetes insipidus, který se může objevit i několik měsíců po úspěšné léčbě. Postižení plic ajater může i po úspěšné léčbě přejít do tzv. fibrosy. Postižení kostí v naprosté většině případů žádné následky nezanechává.
Maligní lymfom (maligní lymfogranulom, morbus Hodgkin)
Definice:
Jedná se o různou skupinu lymfoproliferativních onemocnění, která vzniká maligní transformací lymfocytů na různé úrovni jejich postupného vyzrávání.
Výskyt:
Maligní lymofomy jsou třetím nejčastějším nádorovým onemocněním v dětském věku, postihují asi 10-13% dětských pacientů. Přibližně 55% maligních lymfomů tvoří nehodgkinské lymfomy, 45% tvoří Hodgkinova choroba. Maligní lymfomy je nutno považovat za onemocnění systémové, v době stanovení diagnosy je častá nejen lymfogenní, ale i hematogenní diseminace (krevní cestou).
Poprvé bylo popsáno onemocnění Thomasem Hodgkinem v roce 1832. Histologické rysy definovali v roce 1898 Carl Sternberg a v roce 1902 Dorothy Reedová.
Původ je jednoznačně v lymfocytech, velká většina (98 – 99%) B linie.
Onemocnění se častěji vyskytuje u chlapců než u dívek (poměr 2-3 : 1), méně často se vyskytuje v předškolním věku (průměrný věk činí 11 let), z histologického hlediska převládá nodulární sklerosa, z klinického stadia nejčastěji II A.
Etiopatogeneze:
Významnou roli hraje infekce EBV (Epstein-Barr), přičemž produkt EBV LMP – 1 inhibuje apoptosu (smrt buňky) a facilituje rozvoj maligního lymfomu. U familiární není infekce EBV zaznamenána. Neoplastické buňky, které tvoří 1-5% populace, tvoří masivně fibrogenní a leukotaktické cytokiny (IL – 4, IL – 5, TGF – beta), šíří se v „oderly patern“ : uzliny – slezina – játra – kostní dřeň. Predisponujícím faktorem je dále primární nebo sekundární imunodeficience (tzn. porucha obranyschopnosti organismu).
Příznaky:
Onemocnění v časné fázi postihuje především lymfatické uzliny, později nastupuje orgánové postižení – slezina, játra, plíce, pleura, perikard, střevo, kosti, kůže. Lymfatické uzliny jsou zvětšené, často splývají v pakety, na pohmat nebolestivé, kůže nad nimi je nezměněna. Typická lokalizace je zvětšení uzlin na krku + v nadklíčcích. Toto zvětšení promptně neprogreduje, může trvat týdny i měsíce. Pokud dojde ke zvětšení uzlin v hrudníku (mediastinu), může se manifestovat jako kašel a dušnost, která nereaguje na léčbu antibiotiky. Při zvětšení uzlin v břiše se mohou objevit bolesti břicha event. porucha střevní průchodnosti.
Nejčastější lokalizace ML jsou krční a nadklíčkové uzliny (90%), mediastinální uzliny (60%).
Asi 1/3 nemocných má nespecifické celkové příznaky (tzv. B symptomatologie) – teplota přes 38°C, úbytek na váze více než 10% a noční pocení + svědění kůže. 2/3 nemocných jsou bez celkových příznaků (tzn. A symptomatologie).
Diagnostika:
Anamnesa
Přítomna A či B symptomatogie, EBV infekce, trvání zvětšených lymfatických uzlin.
Hematologické + biochemické vyšetření (tzn. krevní testy)
Vyšetření nespecifické, hodnotíme zánětlivou odpověď organismu, hodnotíme tzv. tu markery – laktátdehydrogenasa (LDH), sedimentace erytrocytů (F.W.), hladinu ferritinu, mědi, thymidinkinasy.
Zobrazovací metody
- Sonografie krku, nadklíčků, axill, břicha, u chlapců event. testes – hodnotíme velikost, tvar, strukturu nejen lymfatických uzlin, ale i parenchymatsoních orgánů (játra a slezina, které mohou být infiltrovány –ložiskové infiltráty hlavně sleziny), infiltrace testes by spíše napovídala, že se o maligní lymfom nejedná – téměř se u tohoto onemocnění nevyskytuje.
- RTG plic – zvětšené uzliny v mediastinu? infiltrace plicního parenchymu? infiltrace pleury?
- CT plic + CT břicha , event. MRI břicha – podrobnější zobrazovací metody
- Aspirace + trepanobiopsie kostní dřeně je prováděna k potvrzení či vyloučení infiltrace kostní dřeně nádorovými buňkami
- Tc kostí – izotopové vyšetření, které odhalí možné kostní metastasy, na základě tohoto vyšetření v případě pozitivity se jsou prováděny ještě cíleně rtg snímky na postižené kosti, event. CT postižené kosti
- PET – pozitronová emisivní tomografie –izotopové vyšetření- znamená velký přínos k upřesnění rozsahu choroby a při hodnocení odpovědi choroby na léčbu
Definitivní diagnosu lze stanovit pouze histologicky z exstirpovaných uzlin, případně excizí z jiných orgánů a tkání, punkce uzliny či orgánu je v tomto případě kontraindikována. Tyto zákroky se provádí většinou v celkové anestesii na operačním sále. Odebraný materiál se odesílá na histologické vyšetření, na cytogenetiku, část vzorku se zamrazuje pro event. další laboratorní vyšetření nutné k diagnose. Rodiče musí být plně informováni o zákroku a o odběru tkáně k diagnostice a ještě před výkonem by měli podespat informovaný souhlas, který je předložen ošetřujícím lékařem pacienta.
Diferenciálně-diagnosticky je nutno odlišit leukemie, nehodgkinské lymfomy, histiocytosu, metastasy solidních nádorů, infekční etiologii (bakteriální, virové, mycoplasmata, antropozoomosy, event. TBC).
Na základě výše uvedených vyšetření určíme rozsah choroby – klinické stadium, na základě histologického vyšetření určíme podtyp choroby.
Klinická stádia:
Stadium I: postižení jedné skupiny lymfatických uzlin nebo jednoho extralymfatického orgánu (IE).
Stadium II: postižení dvou nebo více skupin na jedné straně bránice, popřípadě s postižením sousedního extralymfatického orgánu (IIE).
Stadium III: postižení uzlin na obou stranách bránice, které může být provázeno postižením sleziny (IIIS) nebo lokalizovaným postižením jednoho extralymfatického orgánu (IIIE) nebo obojím (IIISE).
Stadium IV: generalizované onemocnění s difusním postižením jednoho nebo více extralymfatických orgánů, s postižením nebo bez postižení lymfatických uzlin.
Všechna klinická stadia se dělí podle přítomnosti celkových symptomů na podskupinu A či B.
Klinické stadium, sedimentace erytrocytů, přítomnost B symptomatologie, bulky disease (tzn. pakety uzlin větší než 6 cm + mediastinální masa více než 1/3 hrudníku) patří mezi významné prognosticky nepříznivé rizikové faktory.
Histologické podtypy:
- Nodulární sklerosa
- Smíšená buněčnost
- Lymfocytární deplece
- Lymfocyty bohatý
- Lymfocytární predominance
Léčba:
Základem léčby u Hodgkinova lymfomu je kombinovaná chemoterapie a radioterapie. Jejich intenzitu a délku určuje rozsah onemocnění a stupeň rizika. Chirurgická léčba má omezený význam. Je indikována pouze v případě, kdy je možné odstranit 1 ložisko na 1 straně krku ( tzn. kl.st.IA).
- Klinické stadium IA, IIA non bulky - LR ( tzn. nízké riziko ): protokol POG 9426
- Klinické stadium IB, IIB, IA bulky, IIA bulky, IIAS, IIAE, IIIA, IIIAS, IIIAE, IIIAES, IVA - IMR (tzn. střední riziko): protokol AHOD 0031
- Klinické stadium IIIB, IVB - HR (tzn. vysoké riziko): protokol POG 9425
Chemoterapie (tzn. cytostatika) jsou aplikovány nitrožilně. Nejčastěji používaná: Vincristin, Doxorubicin, Cyclophosphamid, Vepesid jsou aplikována buď do periferní žíly, při nedostatečném periferním žilním systému se zavádí centrálně venosní katetr, který vyúsťuje do horní duté žíly.
K usnadnění vylučování rozpadových produktů nádorových buněk jsou pacienti hydratování (tzn. žejsou aplikovány infusní roztoky do žíly, aby nedošlo k poruše funkce ledvin a byla zachována dostatečná diuresa). S chemoterapií jsou podávány jako součást některých léčebných protokolů i kortikoidy, což jsou léky ze skupiny hormonů (Prednison). Chemoterapie je aplikována v cyklech v odstupu 21 – 28 dnů, po určitém počtu cyklů chemoterapie jsou pacienti přešetřováni (zobrazovací metody, tu markerty), přičemž hodnotíme odpověď na léčbu. Pokud je taková, jakou očekáváme, potom pokračujeme v léčebném protokolu. Pokud není žádoucí odpověď, je nutno aplikovat intenzivnější chemoterapii.
Po ukončení chemoterapie pacient, u kterého je zaznamenána regrese choroby (tzn. ústup), absolvuje radioterapii (ozařování) na ta místa, kde byl nádor iniciálně přítomen. Celková dávka radioterapie je 21 Gy a délka činí cca. 15 pracovních dnů. Intenzivní část léčebného protokolu (tzn. chemo + radioterapie) trvá přibližně půl roku.
Po ukončení radioterapie v odstupu 4 týdnů se pacient opět přešetřuje, pokud nejsou známky vitálního nádoru v těle, je dále sledován v určitých časových intervalech ambulatně. V případě progrese choroby se zařazuje vysokodávkovaná chemoterapie s následnou autologní transplantací krvetvorných buněk.
Léčebné výsledky:
Současnými moderními léčebnými metodami lze vyléčit 95% pacientů. Nepříznivou prognosu mají pacienti, kteří nereagují na léčbu aplikovanou iniciálně nebo pacienti s relapsem (opakování) choroby. Taktéž riziko vzniku sekundárních nádorů (nádory prsu, nádory štítné žlázy, leukemie) se mohou u pacientů po 10 letech ukončené léčby objevit 5x častěji než u běžné populace.
Akutní leukémie
Definice:
Zhoubná onemocnění krvetvorby vznikající poruchou ve vyzrávání krevních buněk, které si ponechávají schopnost množení při současné zástavě vyzrávání. Takto porušené buňky nazýváme blasty. Rozlišujeme základní dvě buněčné linie, ze kterých může leukemie vznikat a to linii myeloidní a lymfoidní. Na tomto základě rozlišujeme dva typy akutních leukemií-akutní lymfoblastickou leukemii (ALL) a akutní myleoidní leukemii (AML).
Výskyt:
Leukemie tvoří 30 – 35% včech zhoubných nádorů v dětském věku. Nejčastější formou je ALL, která tvoří 80% leukemií, AML je zastoupena asi 15% a zbytek tvoří vzácná onemocnění hematopoetické kmenové buňky jako je myelodysplastický syndrom (MDS) nebo chronická myeloidní leukemie (CML).
Nejvyšší výskyt ALL mají děti ve věku od dvou do 5 let života. Zcela specifickou jednotkou je ALL u kojenců do jednoho roku života. AML nemá specifický věk vyššího výskytu. Leukemie většinou vznikají u jinak zcela zdravých dětí, i tak se ale předpokládá dosud nedetekovaná porucha genetické výbavy buňky, která této buňce dává růstovou výhodu nad ostatními a dovolí ji nekontrolovatelné množení. V kostní dřeni postižených dětí se skutečně ve většině případů nacházejí změny chromozomů, které mají i prognostický význam. Jen asi 5% leukemií vzniká u predisponovaných jedinců. Neznámnějším syndromem, který je spojen s asi 20 násobně zvýšeným rizikem vzniku ALL je Downův syndrom. Vyšší riziko mají také děti se vzácnými syndromy spojenými s chromozomální nestabilitou jako je Fanconiho anemie a ataxie teleangiektazie.
Akutní leukemie je choroba vznikající v kostní dřeni, kde dochází k nekontrolovanému množení blastů, které v průběhu několika týdnů utlačí veškerou ostatní krvetvorbu. Blasty taktéž velmi rychle opouštějí prostředí kostní dřeně a infiltrují orgány a to nejčastěji oblast mozku a míchy (CNS), játra, slezinu, uzliny a ledviny. U chlapců ALL typicky postihuje varlata. Onemocnění má většinou od počátku rychlou progresi, v případě AML se může jednat až o perakutně probíhající onemocnění bezprostředně ohrožující pacienta na životě. Blasty u AML mají navíc schopnost produkovat látky, které působí poruchu krevního srážení a pacient může mít v době diagnózy těžké až život ohrožující krvácivé projevy.
Příznaky:
Příznaky akutní leukemie vyplývají především z nedostatku krevních elementů, které jsou utlačeny množícími se blasty. Anemie z důvodu nedostatku červených krvinek se projeví bledostí dítěte a zvýšenou únavou. Nedostatek destiček (trombocytů) má za následek tendenci ke krvácení, dítě má modřiny i po minimálním úraze, krvácí z nosu, má tečkovitá krvácení na sliznicích úst, na rtech. Z důvodu nedostatku normálních, funkčních bílých krvinek je dítě velmi náchylné vůči infektu a mnoho dětí s akutní leukemií je krátce před diagnózou opakovaně léčeno pro infekce dýchacích cest a opakované teploty.
Dosti častým příznakem akutní leukemie jsou bolesti dolních končetin, které jsou především klidové, často noční a mohou být i velmi prudké. Končetiny nebývají oteklé a tyto příznaky leckdy vedou děti do péče ortopedů a revmatologů, než se stanoví správná diagnóza.
Množící se blasty mohou, především u AML, dosáhnout v krvi i extrémních hodnot , hovoříme o tzv. hyperleukocytóze, která se může projevit obtížným dýcháním, bolestí hlavy nebo poruchami vidění.
Množení blastů v uzlinách a orgánech se projeví zvětšením příslušných orgánů, zvětšením a bolestí břicha. V případě zvětšení uzlin v hrudníku může být nápadný suchý kašel a obtížné dýchání. Postižení varlat se projeví nebolestivým zvětšením, většinou jednoho, varlete.
Prvním příznakem leukemie u kojenců mohou být nafialovělá ložiska na kůži.
Diagnostika:
Prvním a základním vyšetřením , které se musí provést při podezření na leukemii je vyšetření krevního obrazu . V podstatě u všech dětí s leukemií jsou v krevním obraze patrné změny, které upozorňují, že se s krvetvorbou něco děje. V některých případech je patologie v krevním obraze tak výrazná, že již pouhým vyšetřením krve pod mikroskopem lze stanovit diagnózu . V každém případě je k definitivní diagnóze nutné vyšetření kostní dřeně. Kostní dřeň se vyšetřuje nejenom pod mikroskopem, ale i ve specializovaných imunologických a molekulárně genetických laboratořích. Cílem je přesně určit typ leukemie a její riziko neboť z toho vychází typ léčebného protokolu a jeho intenzita. Jak v rámci ALL tak AML existuje ještě několik podskupin, které se od sebe liší svou závažností a léčba tak musí být "šitá pacientu na míru". V rámci detekce případného postižení mozku a míchy se u každého pacienta provádí vyšetření mozkomíšního moku a NMR mozku. Případné postižení břišních či hrudních orgánů se zjišťuje pomocí UZ a rtg.
Léčba:
Léčba akutních leukemií se děje intenzivní kombinovanou chemoterapií. Chirurgie nemá žádný význam a radioterapie pouze omezený, v případě postižení mozku a varlat.
Chemoterapeutická léčba probíhá podle standardizovaných mezinárodních protokolů. AML je léčena dle protokolu BFM skupiny , v současné době je platný protokol AML BFM 2004. pro léčbu ALL je v současné době platný mezinárodní protokol ALL IC BFM 2002, kde je Česká republika současně i koordinátorem studie. Chemoterapie je velmi náročná, ve své intenzivní části trvá 6 – 8 měsíců a následuje ještě cca 1 rok udržovací léčby. Součástí léčby jsou i pravidelné lumbální punkce s podáním cytostatik do páteřního kanálu k léčbě a prevenci postižení CNS leukemickými blasty. Na počátku léčby je pacient dle vyšetření kostní dřeně zařazen do rizikové skupiny a v průběhu léčby se pravidelně kontroluje periferní krev i kostní dřeň a dle úbytku blastů se případně zvyšuje nebo snižuje intenzita léčby. Přestože k normalizaci nálezu v kostní dřeni a tzv. remisi dojde u většiny pacientů již po prvním měsíci léčby, je nezbytné absolvovat celý léčebný protokol k likvidaci i těch leukemických buněk, které jsou již pod detekční úrovní mikroskopu. V případě zkrácení léčby se výrazně zvyšuje riziko návratu (relapsu) choroby.
Alogenní transplantace kostní dřeně nepatří v současné době do základní léčby ALL ani AML. Je indikována pouze tam, kde pacient špatně odpovídá na standardní léčbu nebo u pacientů s relapsem choroby.
Léčebné výsledky:
Akutní leukemie patří k chorobám, jejichž léčebné výsledky se v posledních dvaceti letech rapidně vylepšily a to především díky standardizované léčbě velkého počtu dětí v rámci mezinárodních protokolů a obrovskému pokroku v podpůrné léčbě, imunologii a molekulární genetice. Pacienti s ALL standardního rizika, což jsou děti ve věku od dvou do 6 let, mají až 80% šanci na vyléčení. Děti s ALL, které mají parametry vysokého rizika, mají šanci na vyléčení sice vyšší než dříve, ale stále se pohybuje kolem 40%.
Z řad pacientů s AML, která je v každém případě obtížněji léčitelná než ALL, se daří v současné době vyléčit 50% pacientů.
Nádory jater – hepatoblastom
Definice:
Nádor vycházející z jaterní buňky.
Výskyt:
Velmi vzácný nádor představující 0,5 – 2% všech nádorů v dětském věku. Typicky se vyskytuje u kojenců a batolat, průměrný věk při diagnóze je jeden rok.
Hepatoblastom bývá sdružen s vrozenými vývojovými vadami jako jsou syndrom Beckwith-Wiedemannův, hemihypertrofie, anomalie ledvin, polycystóza ledvin.
Nádor bývá nejčastěji lokalizován do pravého jaterního laloku. Roste dlouho v játrech, než začne metastazovat. Metastázy nalézáme především v plicích a uzlinách.
Příznaky:
Nejčastějším příznakem hepatoblastomu je pozvolné, nebolestivé zvětšování břicha. S pokročilejším onemocněním se může přidat horečka, nechutenství, zvracení, úbytek na váze.
Diagnostika:
Základem diagnostiky je zobrazovací vyšetření břicha – ultrazvuk a CT břicha. K odhalení metastické choroby je nutné provést CT plic. V krvi jsou u naprosté většiny pacientů enormně zvýšené hodnoty bílkoviny alfa-fetoproteinu, která slouží i jako citlivý marker úspěšnosti léčby a případného návratu choroby. Pokud je fyzikální, laboratotní a zobrazovací nález zcela typický pro hepatoblastom, není při zahájení terapie nutné odebírat ani vzorek tkáně.
Léčba:
Operace má v léčbě hepatoblastomů zásadní význam. Pokud to velikost nádoru dovolí, přistupuje se k operaci již při diagnóze s cílem odstranit celý nádor. V případě, že je nádor příliš velký, léčba se zahajuje chemoterapií a k operaci se přistupuje po zmenšení nádoru. I po úspěšné operaci následuje ještě několik cyklů zajišťovací chemoterapie. V případě inoperabilních nádorů, bez plicncíh metastáz má své místo v léčbě i transplantace jater. Léčba jaterních nádorů probíhá v současné době v ČR dle evropského protokolu SIOPEL.
Léčebné výsledky:
Jsou dobré, pokud je možné nádor radikálně odstranit. Zachránit se v současné době podaří 80% dětí.
Nehodgkinské lymfomy (NHL)
Definice:
Jedná se o heterogenní skupinu onemocnění vycházející z lymfatické tkáně, přesněji z lymfocytů řady B nebo T.
Výskyt:
NHL jsou po leukemiích a mozkových tumorech třetím nejčastějším nádorovým onemocnění. Každým rokem onemocní NHL 9 dětí z miliónu ve věku do 15 let.
Lymfomy patří k nejrychleji rostoucím nádorům, čas potřebný ke zdvojnásobení objemu nádoru může být pouhých 12 hodin. Onemocnění většinou vzniká primárně v lymfatických uzlinách, kdekoliv v těle. Může ale rychle postihovat kostní dřeň, mozkové pleny a infiltrovat orgány, především játra, slezinu, ledviny. Vzácněji vznikne lymfom již na svém prvopočátku mimo lymfatické uzliny – v kostech, mozku, střevech, atd
Zvýšené riziko vzniku NHL mají děti s vrozenými syndromy, které jsou spojené s poruchou imunitního systému. Mezi tyto vzácné syndromy patří především Syndrom ataxie – teleangiektasie a Bloomův syndrom. Ze získaných poruch mají vyšší riziko pacienti s AIDS, pacienti po transplantaci kostní dřeně nebo po orgánových transplantacích.
Příznaky:
Příznaky NHL vyplývají jednak z tlaku a místní deformace z důvodu růstu tumoru a dále jsou poměrně časté příznaky celkové.
Mezi celkové příznaky, které mohou i předcházet viditelnému tumoru, patří recidivující horečky, hubnutí, únava.
Lokálně se onemocnění projeví jako tuhý nádor v místě lymfatických uzlin, který je nebolestivý, kůže nebývá změněna. Nejčastější lokalizací je oblast lymfatických uzlin na krku. Při postižení lymfatických uzlin v hrudníku se nádor projeví suchým kašlem, obtížným dýcháním, někdy otokem obličeje. Rostoucí nádor v břiše má za následek rychlé zvětšování břicha, bolesti břicha, zácpu.
Vzhledem k velmi rychlému růstu tumoru vzniká od počátku v těle mnoho rozpadových buněčných produktů jako je např. kyselina močová, které se usazují v ledvinách a situace může vyústit až do obrazu selhání ledvin. Dítě nápadně málo močí, je oteklé, zhoršuje se zvracení.
Diagnostika:
Základem diagnostiky je odběr vzorku tumoru a jeho vyšetření v patologické, hematologické a imunologické laboratoři. V případě lymfomů se skutečně odebírá jen malý vzorek tkáně, taky aby operace byla co nejšetrnější a nejrychlejší. V žádném případě není cílem chirurgické odstranění celého nádoru, to by naopak mohlo i pacientův stav zhoršit. V rámci pátrání po rozsahu onemocnění se vždy provádí i vyšetření kostní dřeně a mozkomíšního moku. Dále je standardním vyšetřením rtg a CT plic a břicha a vyšetření PET.
Cílem diagnostiky je stanovení nejenom rozsahu nemoci, ale i přesného buněčného podtypu NHL. Léčba jednotlivých podtypů se od sebe významně liší.
Léčba:
Základní léčebnou metodou pro NHL je chemoterapie. Její typ a délka se liší dle podtypu NHL a dle rozsahu iniciálního postižení. V rámci ČR je léčba NHL standardizována dle německých protokolů BFM skupiny. Pro lymfoblastické NHL užíváme léčebný protokol NHL BFM 95. Pro léčbu zralých B lymfomů jsme aktivně zapojeni do léčebné studie dle protokolu B-NHL BFM 04. Pro pacienty s recidivou NHL či onemocněním rezistentním na běžnou chemoterapii je dalším postupem autologní transplantace kmenových buněk. Přesně vymezená skupina pacientů s postižením kostní dřeně může být indikována i k alogenní transplantaci kostní dřeně. Součástí chemoterapie jsou i lumbální punkce s podáváním cytostatik do páteřního kanálu k prevenci recidivy NHL v oblasti mozku a míchy.
Radioterapie má v léčbě NHL jen omezenou úlohu a ve většině případů užívána není. Chirurgie sama o sobě nemá v léčbě NHL vůbec žádný význam.
Léčebné výsledky:
V současné době lze vyléčit až 90% dětí s lokalizovaným onemocněním a 60-75% pacientů s pokročilým onemocněním v době diagnózy.
Neuroblastom
Definice:
Nádor vycházející z tkáně sympatického nervového systému.
Výskyt:
Neuroblastom tvoří 8-10% všech dětských nádorových onemocnění a v průběhu prvního roku života je nejčastějším solidním nádorem. Většina neuroblastomů je diagnostikována do 4 let života.
Nádor je biologicky velmi variabilní, může obsahovat buňky na různém stupni vyzrávání, některé tumory mohou velmi prudce růst, jiné mohou i spontánně vyzrávat a zmenšovat se.
Neuroblastom nejčastěji vychází z nadledvin (asi 40%), dále z nervových pletení podél páteře. Metastázy v době stanovení diagnózy má téměř polovina nemocných, nejčastěji do kostí, jater, kostní dřeně, lymfatických uzlin.
Příznaky:
Závisí na lokalizaci nádoru. Malé neuroblastomy nadledvin u novorozenců se nemusí nijak klinicky projevit a mohou být náhodným nálezem při ultrazvuku břicha z jiného důvodu. Nejčastějším příznakem neuroblastomu je rostoucí tumor způsobující zvětšení břicha či defiguraci krku. Tumory, které rostou podél páteře, mohou prorůstat do páteřního kanálu a působit neurologické poruchy z důvodu lokálního útlaku míchy (obrny dolních končetin, poruchy vyprazdňování stolice). Poměrně často jsou prvním příznakem nemoci až metastázy. Kostní metastázy se projeví zduřením v příslušné kosti. Postižení očnice, které je časté, způsobí otok kolem oka a protruzi bulbu oka.
Z celkových příznaků bývají přítomny horečky, ztráta na váze, nechutenství, noční pocení.
Některé neuroblastomy produkují hormony katecholaminy, které způsobí záchvatovité zvýšení krevního tlaku se zarudnutím kůže.
Diagnostika:
Pro diagnózu je určující histologické vyšetření operačně odebraného vzorku tumoru. Současně se vyšetřuje krev i moč pacienta na přítomnost katecholaminů. K určení rozsahu nemoci je nezbytné vyšetření kostní dřeně, CT či NMR vyšetření hrudníku, břicha a páteře. Cílem vstupního vyšetření je přesné určení stadia a biologické povahy nemoci, která je zcela zásadní pro nastavení léčby.
Léčba:
Léčba neuroblastomů je poměrně složitá ve svém začátku, kdy je nutné vybrat nejvhodnější postup vzhledem k biologii a rozsahu nemoci. Novorozenci s lokalizovaným onemocněním, bez produkce katecholaminů mohou být dokonce jen sledováni, bez léčby a tumor ve většině případů spontánně vymizí. Na druhou stranu pacienti nad jeden rok věku s metastatickým onemocněním zasluhují velmi razantní chemoterapii. Pro pacienty s nejvyšším rizikem je do léčby zavedena i autologní transplantace kmenových buněk či imunoterapie.
Léčebné výsledky:
Přežití dětí s lokalizovanou nemocí ve věku pod rok je excelentní a dosahuje 95%. Pacienti nad jeden rok, kteří nemají metastázy, mají 75% šanci na vyléčení, zatím stále špatná je prognóza dětí starších jednoho roku, které přicházejí s metastatickou chorobou. Zde se i při využití veškerých moderních metod podaří zachránit 10-20% pacientů.
Osteosarkom
Definice:
Osteosarkom je zhoubný kostní nádor.
Výskyt:
Každým rokem je osteosarkom diagnostikován u 4 dětí z jednoho miliónu. Maximum výskytu je mezi 10. a 20. rokem života. Nejčastěji postižené bývají dlouhé kosti dolní končetiny v blízkosti kolenního kloubu. Osteosarkom roste v kosti, kterou destruuje a dostává se do měkkých tkání v okolí kosti. Záhy také metastazuje a to především do plic a dalších kostí.
Příznaky:
Prvním příznakem bývá bolest v postižené kosti, která je typicky klidová a noční. S růstem nádoru se objevuje tuhé zduření, které nemusí být na pohmat bolestivé. V pokročilém stadiu nádoru se může objevit i patologická zlomenina příslušné kosti. Časté jsou i celkové příznaky, jako je noční pocení, teplota, úbytek na váze. Kašel a obtížné dýchání mohou být příznakem plicních metastáz.
Diagnostika:
Osteosarkom se projeví patologií již na prostém rtg snímku, k podrobnějšímu vyšetření se provádí NMR příslušné končetiny. Operačně se potom odebere vzorek tkáně a stanoví se přesná histologická diagnóza. K posouzení rozsahu onemocnění se provádí CT plic a scintigrafické vyšetření skeletu.
Léčba:
Klíčem k úspěchu léčby je radikální chirurgické odstranění nádoru, buď amputací nebo, častěji, kostní náhradou. Pacienti, u kterých není možná žádná radikální operace, mají léčebné výsledky podstatně horší. Po stanovaní diagnózy je většinou léčba zahajována chemoterapií ke zmenšení nádoru, poté následuje radikální operace a následně opět chemoterapie. Osteosarkomy jsou obecně málo citlivé k radioterapii.
Léčba osteosarkomů v České republice je nyní standardizována dle severoamerického COG protokolu EURAMOS.
Léčebné výsledky:
Pacienti s radikálně operovaným nádorem a dobrou odpovědí na chemoterapii mají až 80% šanci na vyléčení. S nemožností radikální operace (např. nádory páteře a pánve), špatnou odpovědí na chemoterapii nebo přítomností plicních metastáz se šance na vyléčení úměrně snižuje.
Retinoblastom
Definice:
Retinoblastom (RB) je zhoubným nádorem oka, který má původ v sítnici.
Výskyt:
Odhaduje, se, že RBL se vyskytuje s četností 1 nádor na 18000 novorozenců za rok. Dvě třetiny nádorů se diagnostikují v prvních 3 letech života, maximum je v prvním a druhém roce věku. Po šestém roce života je RBL jen velmi výjimečný. Asi 20-30% dětí má při diagnóze nádor oboustranný.
Asi v 5% případů je nemoc podmíněna geneticky, přítomností tzv. retinoblastomového genu (Rb1gen), který je předáván z generace na generaci. Pravděpodobnost, že postižený rodič bude mít stejně postižené dítě je asi 25%. V současné době je možné tento gen v rodině detekovat.
Příznaky:
Nádor, pokud je malý, může zůstat klinicky němý, protože malé dítě nedá nikterak najevo, že ztrácí zrak. S tím , jak dítě s rostoucím tumorem ztrácí zrakovou ostrost na jednom oku, začíná šilhat.Náhle vzniklé šilhání u malého dítěte je tedy důvodem k pečlivému očnímu vyšetření. Prvním příznakem, kterého si rodiče často všimnou, bývá změna odlesku světla v oku na bělavý odlesk. Nápadný je většinou rozdíl v odlesku zdravého a nemocného oka. Známkou pokročilejší nemoci je šedobělavé zabarvení zornice, tzv. leukokorie.
Při dalším růstu nádoru se objeví zvětšování oka, zarudnutí a otok okolí oka.
Nádor může mimo oko postihovat především oblast mozku a míchy.
Diagnostika:
Diagnózu stanoví pečlivé oční vyšetření, které se většinou u malých dětí provádí v celkové anestezii. Nádor je svou lokalizací tak typický, že není vyžadována ani histologická diagnostika. V rámci stanovení rozsahu nádoru je nutné vyšetření obou očí, NMR mozku a míchy, vyšetření mozkomíšního moku.
Léčba:
Způsob léčby závisí na počátečním rozsahu nemoci. Osvědčená je kombinace chemoterapie a lokální terapie (kryoterapie, nitrooční podání cytostatik). V některých případech je nutné přistoupit k enukleaci oka a jeho náhradě protézou. Léčba RBl je velmi individuální a odehrává se v těsné spolupráci onkologů a oftalmologů. Jen zřídka se užívá radioterapie, neboť její vedlejší účinky u malých dětí v oblasti obličeje jsou kosmeticky velmi závažné.
Léčebné výsledky:
Léčebný úspěch významně závisí na včasném odhalení choroby. U nádorů, které jsou v době diagnózy pouze uvnitř oka, je úspěšnost léčby 90 – 100%. Naproti tomu děti, které přicházejí s onemocněním zasahujícím mimo oblast oka, přežívají pouze v 10%.
Důležité je zmínit i vyšší riziko následných (sekundárních) nádorů u dětí s geneticky podmíněnou chorobou (Rb1 gen). Tyto děti mohou mít za několik let po úspěšně odléčeném RBL další zhoubné onemocnění, typickým nádorem je osteosarkom.
Sarkomy měkkých tkání
Definice:
Nádory, které vycházejí z pluripotentní mesenchymální buňky, tedy základní buňky svalů a pojivové tkáně.
Výskyt:
Sarkomy (SA) měkkých tkání tvoří asi 6 – 15% všech nádorů dětského věku. Výskyt nádorů je rovnoměrný v průběhu celého dětství. Všechny nádory vyrůstají v oblasti svalů nebo pojivové tkáně. V rámci skupiny sarkomů rozeznáváme na základě biologické charakteristiky tři podskupiny: rhabdomyosarkom, synovialosarkom a nediferencovaný sarkom. Asi 80% všech sarkomů představuje právě rhabdomyosarkom (RS).
Nejčastější lokalizací SA je oblast hlavy a krku, dále uropoetického systému, měkkých tkání končetin a trupu. Jedná se o velmi rychle a agresivně rostoucí nádory, které prorůstají do okolních tkání a rychle metastazují do plic, lymfatických uzlin a kostní dřeně.
Příznaky:
Liší se podle lokalizace nádoru. Nejčastěji se projevuje jako tuhé, nebolestivé zduření. Při dalším růstu nádoru se objeví příznaky z poruchy funkce okolních struktur, např. obrny nervů, poruchy močení. Při lokalizaci ve středních uchu nebo v oblasti nosohltanu může být prvním projevem výtok z ucha či nosu, pocit ucpaného nosu. Otok víček s protruzí očního bulbu je příznakem při lokalizaci sarkomu v očnici. Sarkomy v urogenitální oblasti se projeví krvavým výtokem z pochvy u děvčátek, u chlapců se objevuje obtížné močení, zduření varlat, krvavá moč.
Diagnostika:
Dle lokalizace tumoru je vstupním vyšetřením k objasnění velikosti nádoru a jeho vztahu k okolí ultrazvuk, CT nebo NMR. Pro zhodnocení rozsahu nádoru a odhalení metastáz je nutné vyšetření kostní dřeně, CT plic, scintigrafie kostí.
Definitivní diagnóza je opět histologická ze vzorku tkáně odebraného při diagnóze. Pro správné nastavení další léčby je nutné přesné určení podskupiny sarkomu.
Léčba:
Léčebný postup je závislý na typu sarkomu a iniciálním rozsahu onemocnění. V léčbě jsou kombinovány všechny tři metody – chemoterapie, radioterapie a chirurgie. Pokud to velikost tumoru dovolí, je snaha již na počátku léčby tumor odstranit nebo se pokusit o odstranění co největší části tumoru. V případě, že by tento zákrok představoval na počátku pro pacienta příliš velké riziko, léčba se zahajuje rovnou chemoterapií, s cílem zmenšit nádor a umožnit operaci v pozdější době. Chemoterapie je kombinovaná, často velmi intenzivní. Pro část vysoce rizikových pacientů je v léčbě užíváno i ozařování na oblast nádoru.
Pro pacienty s velmi nepříznivou prognózou se v současné době zkoušejí experimentální přístupy včetně alogenní transplantace kostní dřeně.
Léčebné výsledky:
Děti s lokalizovaným nádorem, kompletně odstraněným chirurgicky mají příznivou prognózu s 80% vyléčených pacientů. Děti s lokálně pokročilým onemocněním, které není radikálně chirurgicky řešitelné mají zhruba 60% šanci na přežití. Prognóza je zatím stále velmi špatná pro děti přicházející s metastatickýcm onemocněním, kde šance na vyléčení klesá na 20%.
Tumory centrální nervové soustavy (CNS) – mozku a míchy
Definice:
Nádory vycházející z mozku a míchy.
Výskyt:
Nádory vycházející z mozku a míchy jsou nejčastějšími nádory u dětí a tvoří asi 20% všech nádorů tohoto věku.
Nádory v této lokalizaci se rozdělují podle typu buněk, ze kterých vycházejí. Vzhledem k velké rozmanitosti buněk nervové soustavy je klasifikace mozkových tumorů poměrně složitá a celkem zahrnuje osm základních skupin. Mezi nejčastější nádory patří gliomy, meduloblastomy a ependymomy.
Zdaleka ne všechny mozkové tumory jsou zhoubné svojí povahou, především mezi gliomy je velká část tumorů, které rostou velmi pomalu a nemetastazují. I benigní tumory ale bohužel mohou být životu nebezpečné, pokud rostou v místě mozku nepřístupném operaci, v blízkosti životně důležitých center. U mozkových tumorů tak často, daleko více než na vlastní povaze nádoru, záleží na jeho poloze v mozku.
Příznaky:
Záleží na místě v nervové soustavě, ze kterého nádor vychází a také na rychlosti růstu. Zvláště u pomalu rostoucích nádorů mohou někdy příznaky trvat a postupně se zhoršovat až několik měsíců, než je nemoc odhalena. Obecně každá několik týdnu trvající bolest hlavy u dítěte, doprovázená zvracením, bez známek infekce si zaslouží podrobnější vyšetření dětským lékařem či neurologem.
Společným příznakem prakticky u všech nádorů je bolest hlavy, která je způsobena zvýšeným tlakem v hlavě (nitrolební tlak) při růstu nádoru. Bolest je většinou popisována jako tlaková, nepřesně lokalizovaná, je horší po ránu a při zatlačení na stolici.
Zvracení bývá náhlé, většinou po ránu a bez nechutenství.
Poruchy viděníse projevují pokud jsou tumorem postiženy okohybné nervy. Nejčastěji jde o dvojité vidění, rozmazané vidění nebo zúžení zorného pole.
Z lokalizace tumoru vyplývají neurologické příznaky. U nádorů postihujících oblast mozečku (zadní jáma lební) je nápadná porucha rovnováhy, chůze jako v opilosti a porucha koordinace jemných pohybů – zhoršuje se např. psaní. U nádorů v mozkových hemisférách se projeví porucha hybnosti končetin či celé poloviny těla - slabost v končetině, poruchy chůze, napadání na končetinu. Dále může dojít k poruše řeči, u nádorů v čelním laoku může být nápadná změna chování. Vzácně se mohou nádory mozku projevit poruchou růstu, nebo nástupem předčasné puberty.
Křečemohou být projevem tumoru mozku v kterékoliv lokalizaci a mohou postihovat celé tělo nebo jen určitou skupinu svalů (končetiny, obličej..).
Nádory míchy nejsou doprovázeny bolestí hlavy ani zvracením. Mohou se projevit jako nespecifické bolesti v zádech a především poruchou hybnosti až ochrnutím končetin. Může se objevit i porucha nervů ovládajících močení a činnost střev s následnou zácpou a obtížným močením.
Diagnostika:
Neurologické vyšetření u dítěte přicházejícího s výše uvedenými příznaky pomůže odhalit i méně nápadné neurologické postižení a s určitou přesností odhadne lokalizaci tumoru. K odhalení zvýšeného nitrolebního tlaku může pomoci oční vyšetření. Diagnózu ale stanoví zobrazovací metody – CT a/nebo NMR. Pokud je nádor nalezen v mozku, vždy se provádí i vyšetření míchy a naopak.
Ke správnému rozhodnutí o léčbě je nutná histologická diagnóza se stanovením přesného typu tumoru. Vzorek tumoru se získá operací.
Léčba:
Prvním a ve většině případů nejdůležitějším krokem v léčbě tumorů CNS je chirurgie. Po odhalení tumoru na CT či NMR se ve většině případů přistupuje k operaci, jejímž cílem je odstranění co největší porce nádorů. Po operaci se o další léčbě rozhoduje na základě znalosti histologické diagnózy a pooperačního rozsahu nádoru (zbytek nádoru, metastázy v míše). Pacienti s příznivým typem nádoru ( např.gliomy), které se podaří operací kompletně odstranit, nemusí dokonce dostávat žádnou další léčbu. U ostatních je většinou druhým krokem po operaci ozařování oblasti tumou a v některých případech i preventivní ozařování celého mozku a míchy ke snížení rizika recidivy tumoru.
Chemoterapie následuje radioterapii, v některých případech probíhá nízce dávkovaná chemoterapie i současně s radioterapií. S výjimkou meduloblastomu a germinálních nádorů jsou mozkové nádory na chemoterapii jen málo citlivé a její role je tak omezená. V případě meduloblastomů je pro rizikové pacienty indikována i vysokodávkovaná chemoterapie s autologní transplantací kmenových buněk. Léčba mozkových tumorů probíhá podle standardizovaných evropských a především severoamerických protokolů skupiny COG.
Léčebné výsledky:
Prognóza mozkových tumorů u dětí je dána především rozsahem onemocnění, histologickým typem nádoru a radikalitou operace. V případě gliomů, které se podaří kompletně odstranit je přežití pacientů až 90% . Děti s kompletně operačně odstraněnými meduloblastomy bez metastáz přežívají svou nemoc až v 80%. Procento úspěšnosti se ale prudce snižuje u pacientů s metastázami nebo neúplně odstraněným tumorem, kde dosahuje 40-60%. Velmi špatná je prognóza malých dětí s generalizovaným inoperabilním onemocněním.
Děti po léčbě mozkového tumoru patří mezi pacienty s nejzávažnějšími pozdními následky a vyžadují dlouhodobou péči i po úspěšné léčbě.
Tumory ledvin – nefroblastom (Wilmsův nádor)
Definice:
Nefroblastom (Wilmsův nádor, WT) je zhoubný nádor vycházející z ledviny.
Výskyt:
Nefroblastom tvoří asi 5 – 6 % nádorů dětského věku a jedná se šestý nejčastější nádor u dětí. Je typickým nádorem dětí předškolního věku, maximum výskytu má mezi 2. a 3. rokem života. Asi u 7% dětí postihuje obě ledviny.
Poměrně často bývá WT sdružený s jinými anomáliemi, nejčastější je tzv. aniridie (chybění duhovky). Dále bývá doprovázen vrozenými vývojovými vadami urogenitálního traktu nebo poruchami růstu tzv. hemihypertrofií. Mezi vrozené syndromy, které mají vysoké riziko vzniku WT patří syndrom Beckwith-Wiedemannův a syndrom Drashův. Děti s těmito syndromy musí být minimálně prvních 6 let života sledovány onkologem.
Příznaky:
Suverénně nejčastějším příznakem, který upozorní na možnou diagnózu WT je zvětšení bříška, kterého si všimnou rodiče nebo při kontrolní prohlídce dětský lékař. Bolesti břicha dítě většinou nemá a další obtíže, pokud vůbec jsou, mohou být jen nevýrazné poruchy jako nechutenství, zácpa, zvracení, teploty. Asi u 20% dětí se onemocnění může poprvé projevit krvavou močí tzv. hematurií. Hematurie je u dětí vždy důvodem k ultrazvukovému vyšetření břicha.
Diagnostika:
Základem stanovení správné diagnózy je v první řadě ultrazvukové vyšetření břicha a následně k přesnému posouzení rozsahu tumoru i CT vyšetření břicha. K vyloučení metastatického postižení se provádí rtg a CT plic.
Definitivní diagnóza je histologická, to znamená vyšetření tkáně z vyoperovaného tumoru.
V případě nefroblastomu zobrazovací vyšetření spolu s klinickým obrazem dávají diagnózu s takovou přesností, že u většiny dětí neprovádíme operaci a histologické vyšetření nádoru hned na začátku, ale k operaci přistupujeme až po 4 týdnech chemoterapii. Nádor je v této době často menší a umožňuje bezpečnější operaci.
Léčba:
Léčba WT kombinuje chirurgický zákrok s chemoterapií, ve vybraným případech je užívána i radioterapie. V současné době jsou děti v ČR léčeny dle evropského protokolu SIOP 2001. Protokol nabízí několik variant intenzivity léčby, v závislosti na počátečním rozsahu (klinickém stadiu) i a histologické charakteristice tumoru.
Cílem chirurgického zákroku je odstranění celé ledviny s nádorem a okolními uzlinami, buď na začátku léby nebo až po úvodní 4 týdenní chemoterapii. Nádor a uzliny jsou podrobně vyšetřeny patologem a na základě tohoto vyšetření je stanoven další plán chemoterapie. Ta může být velmi krátká (4 týdny), ale i několikaměsíční. U vybraných dětí s vysokým rizikem recidivy tumoru je do chemoterapie zařazeno i ozařování na oblast tumoru či metastáz.
Léčebné výsledky:
V současné době se daří vyléčit 90% dětí s lokalizovaným onemocněním, tedy s onemocněním, které není rozšířeno mimo ledvinu. Děti s oboustrannými nádory a nádory rozšiřenými mimo ledvinu přežívají v 60%.
Autologní transplantace a kmenových buněk krvetvorby (ASCT)
Princip:
Principem této metody je podání extrémně vysokých dávek chemoterapie, která usmrtí buňky nádorové, ale nevyhnutelně vede k definitivnímu zničení vlastních krvetvorných buněk. Část krvetvorných buněk je proto před podáním chemoterapie pacientu odebrána, zamražena a po podání chemoterapie jsou buňky opět navráceny. Název autologní znamená, že pacientu je vrácena jeho vlastní kostní dřeň.
Kdy se metoda používá:
Obecně v léčbě onemocnění, která jsou citlivá na chemoterapii a nepostihují kostní dřeň. Tato léčba však sebou nese i vysoké procento komplikací a proto je vyhrazena jen přísně selektované skupině pacientů s nejrizikovějšími typy nádorů nebo recidivami nádorů. Mezi nádory, u kterých se tato metoda používá, patří patří meduloblastom, Ewingův sarkom, Hodgkinovy lymfomy a nádory ze zárodečných buněk.
Kdy je vhodná doba k transplantaci:
Transplantace má význam v okamžiku, kdy je nádor již zmenšen, v ideálním případě úplně zničen předchozí standardní chemoterapií. I v době, kdy již nádor není viditelný na zobrazovacích metodách, může v těle zůstávat ještě množství nádorových buněk, které po ukončení léčby dávají vznik recidivě nádoru. ASCT má za úkol zbavit organismus právě těchto zbytkových buněk. Nikdy tak není prováděna na počátku léčby, ale vždy až na její závěr, po několika cyklech standardní chemoterapie. Výjimkou jsou mozkové nádory, kdy jsou transplantace prováděny v několika cyklech za sebou od počátku léčby. V tomto případě je však jednotlivá dávka chemoterapie nižší.
Kdy a jak se odebírá kostní dřeň:
Nejvhodnější doba k odběru kostní dřeně je většinou na počátku léčby nebo po několika úvodních blocích chemoterapie. V současné době se v naprosté většině případů již neodebírá kostní dřeň , ale zárodečné buňky kostní dřeně, tzv. periferní kmenové buňky. Ty se účinkem chemoterapie a speciálních růstových faktorů (růstový faktor pro granulocyty, G-CSF, Neupogen) vyplavují do periferní krve. Jakmile dosáhne počet kmenových buněk v periferní krvi určitého počtu, krvinky se odebírají speciálním zákrokem, který se nazývá separace. Během této procedury prochází krev pacienta přes přístroj, který z ní odstraňuje kmenové buňky, krev se po průtoku přístrojem vrací ihned zpět do krevního oběhu pacienta. Před zákrokem je nutné zavést žilní katetr, většinou do stehenní žíly, ze kterého je krev odsávána a současně navracena. Zákrok samotný trvá asi 2 – 4 hodin a je pro pacienta zcela nebolestivý, pacient v průběhu zákroku leží pohodlně na lůžku, může sledovat televizi atd. Separace probíhá v jednom nebo několika dnech po sobě, dokud není nashromážděn dostatečný počet kmenových buněk. Ty jsou potom uchovávány ve zmraženém stavu na tkáňové bance, dokud je pacient nezačne potřebovat. >>Podrobné informace o separaci kmenových buněk.
Transplantace:
Samotná transplantace kostní dřeně nebo kmenových buněk se podobá krevní transfuzi. Po úvodních několika dnech vysokodávkované chemoterapie jsou pacientu převedeny rozmražené kmenové buňky a to formou krátké transfuze do žíly. Samotné podání kmenových buněk může být provázeno nežádoucími účinky, jako je alergická reakce, kašel, pokles krevního tlaku, zpomalení akce srdeční. Z tohoto důvodu je pacient v průběhu podávání transfuze kostní dřeně nebo kmenových buněk pečlivě sledován a před podáním jsou mu aplikovány léky ke snížení rizika výskytu těchto komplikací.
Po transplantaci:
V prvních 24 – 48 hodinách po transplantaci může pacient cítit nevolnost a může zvracet. Po podání transfuze kmenových buněk či kostní dřeně do krevního oběhu dojde k uvolnění tzv. dimethysulfoxidu (DMSO), látky, která zajišťuje životaschopnost krevních buněk v zamraženém stavu. Látka se z pacienta vylučuje močí a potem, což má za následek charakteristický zápach, který může být nepříjemný, ale vymizí v průběhu prvních 48 hodin. K urychlení vyloučení DMSO je nutné dobré zavodnění pacienta.
Podané krevní buňky si najdou cestu do kostní dřeně, kde „zahnízdí“ a začnou se množit. Po několika dnech (v průměru 8 – 12 dní) dají vznik nové populaci krevních buněk a v krevním obraze pacienta se začnou objevovat všechny krvinky a pacient přestává potřebovat transfuze. Tomuto okamžiku říkáme přihojení. Do doby přihojení je pacient v těžké neutropenii, trombocytopenii a anemii. Potřebuje transfuze krvinek a na podporu množení bílých krvinek i růstové faktory pro bílé krvinky (G-CSF).
Komplikace transplantace, léčba a prevence, režim na transplantační jednotce:
Obávanou komplikací jsou především infekce, jejich nejvyšší nebezpečí je do doby přihojení. Díky vysokým dávkám chemoterapie se mohou vyskytnout i komplikace z poškození orgánů, které se nevyskytují při obvykle používaných nižších dávkách chemoterapie. Jedná se o poruchy jater, ledvin a poškození sliznic, tzv. mukositida. Z těchto důvodů je každý pacient před transplantací pečlivě vyšetřen, aby se zjistilo, zdali je vůbec transplantace schopen. Až do přihojení nebo do zvládnutí komplikací je pacient vždy umístěn na izolační box, kde s ním je vždy jeden člen rodiny. Do přihojení nejsou povoleny žádné jiné návštěvy. Na box je možno si sebou vzít osobní věci a hračky po předchozí domluvě s personálem. Všechny tyto předměty musí cestou do boxu projít desinfekcí. >>Podrobné informace o režimu na transplantačním pokoji. Izolační box je vybaven speciálním vzduchovým filtrem ke snížení rizika infekcí, pacient dostává speciální nízkobakteriální stravu. Antibiotika, léky na podporu jaterních funkcí a protivirové léky se užívají ještě několik týdnů po transplantaci ke snížení rizika pozdních komplikací.
Principy onkologické léčby
Chirurgická léčba >>>>
Chemoterapie >>>>
Radioterapie >>>>
Chirurgická léčba
Úloha:
"Rakovinu nožem neporazíš" ... tak zní ve volném překladu věta z jedné souhrnné práce na téma dětské onkologie. Obsahuje smutnou pravdu, že skutečné maligní (tedy rakovinové) bujení lze chirurgickou léčbou dočasně z organismu odstranit, ale nelze tímto způsobem organismus definitivně vyléčit. Nicméně chirurgická léčba je součástí léčebného plánu většiny onkologických onemocnění. Její úloha je v podstatě dvojí:
1. odběr vzorku nádoru k histologickému vyšetření a stanovení diagnosy
2. zmenšení množství nádorových buněk v organismu
Indikace:
Zatímco úloha chirurgie v bodě jedna je zcela jasná, v bodě druhém není její indikace jednoznačná. Obecně platí, že čím je více nádor citlivý na chemoterapii a/nebo radioterapii, tím menší úlohu hraje v jeho vyléčení léčba chirurgická.
U nádorů, jako jsou např. lymfomy či veškeré leukemie, jakékoliv pokusy o zmenšení nádoru nepřinášejí pacientu léčebnou výhodu. V případě celé řady jiných nádorů jako sarkomy, neuroblastomy či tumory ledvin přináší maximální možné chirurgické odstranění tumoru pacientům výhodu, ovšem pouze pokud je současně podávána chemoterapie, na kterou je daný nádor citlivý. Je nutné si uvědomit, že indikace chirurgického výkonu patří mezi nejvíce individuální rozhodnutí v onkologii a nelze dát v tomto směru jednoduché doporučení, které by vyhovovalo všem pacientům a všem typům nádorových onemocnění. Na jedné misce vah je vždy přínos úplného chirurgického odstranění ( tzv. radikální operace) a na straně druhé následky vyplývající z radikality operace, které mohou být i velmi závažné a trvalé- amputace, trvalá invalidita , poruchy mozkové činnosti.
Z výše uvedeného vyplývá, že o operačním řešení nádoru nerozhoduje jeden člověk, ale vždy je to týmová práce onkologa, chirurga, rentgenologa a v neposlední řadě je to rodič nebo sám pacient, který má právo říci, zda-li je ochoten, ve světle očekávaného léčebného výsledku, podstoupit pro něho potenciálně invalidizující výkon.
Pracoviště:
Chirurgické zázemí dětské onkologie v Brnězajišťuje Klinika dětské chirurgie a ortopedie (KDCHOT) pod vedením přednosty Prof. Petra Gála. Specializované kostní operace jsou prováděny na ortopedické klinice Nemocnice u Svaté Anny (ODKAZ). Jediné operace prováděné mimo Brno jsou operace jater. K těmto raritním operacím jsou děti odesílány do specializovaného centra na Klinice dětské chirurgie FN Motol v Praze.
Rehabilitace:
Na tomto místě je nutno zmínit velmi dobrou spolupráci s rehabilitačním oddělením Dětské nemocnice pod vedením primáře MUDr. P. Braunera. Pacientům, kteří podstoupili chirurgické výkony s nutností další rehabilitační péče či dokonce výkony spojené se ztrátou končetiny toto oddělení poskytuje okamžitou a dlouhodobou rehabilitační pomoc, se zajištěním veškerých pomůcek v ústavní i domácí péči.
Chemoterapie
Účel chemoterapie:
Chemoterapie je označení pro léčbu zhoubného nádoru pomocí léků, které se nazývají cytostatika.
Chemoterapie může být jedinou modalitou léčby pacienta v případě leukemií či lymfomů. V případě většiny ostatních nádorů však navazuje na předchozí léčbu chirurgickou jako tzv. adjuvantní chemoterapie. Zde je jejím cílem zničit zbývající buňky po operaci a snížit na minimum riziko recidivy (návratu) či metastazování nemoci.
Chemoterapie může být použita i před operací s cílem zmenšit nádor a ulehčit tak operační postup. V tomto případě mluvíme o neoadjuvantní chemoterapii.
Často po určitou dobu probíhá současně s chemoterapií také radioterapie (ozařování) na místo nádoru či metastázy. Mluvíme o tzv. konkomitantní chemoradioterapii a cílem je spojit lokální protinádorovou léčbu (radioterapie) s léčbou systémovou (chemoterapie ).
Cytostatika:
Pojem cytostatikumzahrnuje pestrou škálu léků, jejichž společnou vlastností je ničení živých buněk. Cytostatika se navzájem liší ve způsobu, kterým poškozují buňky,liší se ve své schopnosti průniku do některých tkání jako je např. mozek a stejně tak jsou mezi nimi i podstatné rozdíly, co se týče jejich nežádoucích účinků. Cytostatikum, které má vynikající účinek na jeden typ nádoru, může být zcela neúčinné na nádory ostatní. Ve světle různých "senzačních" zpráv ze sdělovacích prostředků je nutno mít na paměti, že zatím nikde na světě neexistuje universální cytostatikum s excelentním účinkem na všechny typy nádoru.
Cytostatikavšak nejsou schopna v organismu rozpoznat zdravé buňky od nádorových, ve své podstatě ničí všechny živé buňky v těle. Zjednodušeně lze říci, že čím rychleji se daná skupina buněk v organismu dělí, tím citlivější jsou k účinku cytostatika. Nádorové buňky by tak měly patřit k těm nejcitlivějším. Z účinku cytostatik na ostatní dělící se zdravé buňky v těle vyplývají jejich početné nežádoucí účinky. Podrobné informace o nežádoucích účincích chemoterapie, jejich prevenci a léčbě dostanete v kapitole Komplikace onkologické léčby na těchto stránkách.
Tak, jak se cytostatika mezi sebou liší způsobem zabíjení nádorových buněk, mohou být v některých případech s výhodou mezi sebou kombinována v rámci jednoho léčebného procesu. Pacient tak dostává různé typy cytostatik v přesně časovaném schematu, tzv. cyklu léčby. Série cyklů potom tvoří léčebný plán neboli protokol jedinečný pro každý typ nádorového onemocnění. Interval mezi cykly léčby je většinou 3 týdny. V této době se musí zdravé buňky organismu zregenerovat z poškození cytostatiky, tak aby organismus jako celek byl schopen pokračovat v chemoterapii. Pokud by ale interval mezi cykly byl příliš dlouhý, mohlo by dojít i k regeneraci buněk nádorových. Proto se vždy snažíme předepsaný interval mezi cykly či dávkami cytostatik maximálně dodržet. Jistě jsou však situace, kdy je rozhodně bezpečnější pro zdraví pacienta s další chemoterapií vyčkat o něco déle. Toto rozhodnutí je vždy přísně individuálně zvažováno a je v rukou ošetřujícího lékaře.
Délka chemoterapie:
Celková délka protinádorové chemoterapietrvá ve většině případů nejméně 3 měsíce a vyjímečně až 3 roky. Jistě to však neznamená, že pacient je po celou dobu na lůžku v nemocnici. Naopak. Pobyt v nemocnici je zkracován na minimum. Pacient je přijímán na lůžko pouze k podání cyklu léčby, po kterém je propuštěn domů. Podmínkou propuštění je samozřejmě dobrý celkový stav, bez infekce. Některé cykly léčby je navíc možno podat ambulantně, bez nutnosti hospitalizace dítěte. Druhým důvodem k přijetí bývají komplikace onkologické léčby, jako je infekce, útlumy krvetvorby atd. Jistě se může stát, že dítě stráví v nemocnici delší dobu kvůli léčbě komplikací, než pro podávání samotné chemoterapie.
Způsob podávání cytostatik:
Většina cytostatik jsou léky určené k nitrožilnímu podání formou krátké či vyjímečně delší, až 24 hodinové, infuze. Minimum cytostatik je podáváno ve formě tablet.
Nitrožilní podání klade vysoké nároky na žilní systém pacienta. U většiny dětí je nutné zavedení takzvaných centrálních žilní katétrů k bezpečné a komfortní nitrožilní aplikaci cytostatik. Cestou nitrožilních katétrů současně probíhají veškeré krevní odběry po dobu léčby. Centrální žilní katétr je tenká trubička z umělé hmoty (polyurethanu), která se v krátké celkové anestezii zavede do podklíčkové nebo jugulární žíly, tak aby konec trubičky byl na přechodu horní duté žíly v pravou srdeční síň,viz schéma. Opačný konec katétru je veden cca 10 cm pod kůží a navenek ústí buď koncovkami se zátkou nebo je ukončen rovnou pod kůží malou komůrkou (portem), která se v případě potřeby vstupu do katétru napichuje přes kůži speciální tenkou jehlou. V ideálním případě je takto zavedený katétr v žíle po celou dobu intenzivní léčby.
Přibližně u 25 % pacientů se v průběhu jeho používaní vyskytnou komplikace, většinou nezávažné. Jedná se především o krátkodobé poruchy průchodnosti katétru, povysunutí katétru z ideální pozice, infekce kůže v okolí katétru. Mezi závažnější, ale naštěstí méně časté komplikace, patří infekce sídlící uvnitř katetru nebo krevní sraženina v žíle s katetrem. Všem těmto komplikacím se snažíme předcházet a to především dodržováním zásady manipulace s katétrem za sterilních podmínek, minimalizujeme počet vstupů do katétru a pečlivě kontrolujeme stav kůže v okolí katétru. Každý pacient, který má zavedený centrální žilní katetr, obdrží tištěné ponaučení, jak s katétrem zacházet. Většinu komplikací se daří zvládat aniž bychom byli nuceni katétr vyjmout z těla. Některé mechanické a především infekční komplikace si však mohou pro bezpečnost pacienta vyžádat vyjmutí katétru a po zvládnutí infekce je možné zavést katétr nový.
I přes zmíněné problémy znamenají centrální žilní katétry obrovský přínos pro pacienta, především pro děti, které nemusí trpět bolestí z opakovaných vpichů do žil a z mimožilního úniku léku při prasknutí žíly. U většiny dětí bychom bez centrálního žilního katetru nebyli schopni chemoterapii bezpečně podat.
Vysokodávkovaná chemoterapie:
Samostatnou kapitolou je tzv. vysokodávkovaná chemoterapie, kdy jsou podávány extrémně vysoké dávky cytostatik. Tyto dávky mají sice významný účinek na samotný nádor, ale současně působí nevratné změny krvetvorbě. Podání vysokodávkované chemoterapie tak musí byt zajištěno transplantací kmenových buněk krvetvorby či kostní dřeně. Pokud je navrácena pacientova vlastní kostní dřeň či kmenové buňky, mluvíme o tzv. autologní transplantaci, v případě použití dárcovských kmenových buněk, hovoříme o alogenní transplantaci. Vysokodávkovaná chemoterapie je načasována většinou na úplný konec plánované léčby a je předcházena několika cykly běžně dávkované chemoterapie.
Radioterapie
Co je a k čemu slouží radioterapie:
Radioterapieje léčebná metoda, která využívá působení ionizujícího záření na buňky. Biologicky účinek záření na buňku lze rozdělit na přímý a nepřímý. V případě přímého účinku reaguje částice záření přímo s nukleovými kyselinami v jádře buňky a buňka je tímto zničena. Při nepřímém účinku dochází vlivem záření k tak zásadní změně v okolí buňky, že buňka v tomto prostředí zmírá.
V léčbě nádorových onemocnění v dětském věku bývá jen zřídkakdy použito radioterapie jako jediné léčebné metody. V naprosté většině případů probíhá současně nebo krátce po chemoterapii. Radioterapie je namířena na místo původního nádoru nebo jeho metastáz a svým lokálním účinkem doplňuje systémový účinek chemoterapie. Stejně jako v případě chemoterapie nejsou všechny nádory na účinek radioterapie stejně citlivé, čili, ne ve všech případech je tato metoda indikována. Nádory většinou indikované k radioterapii jsou nádory mozku, Hodgkinské lymfomy a některé sarkomy měkkých tkání (např. rhabdomyosarkom).
Zdrojem zářeníjsou vysokoenergetické (megavoltážní) zdroje, například kobaltový zářič.
Ohraničení a dávkování:
Před zahájením radioterapie je nutno pečlivě ohraničit ozařovanou oblast těla, tak aby se paprsky nedostaly do sousedních oblastí a nedošlo k poškození zdravých tkání. Tato fáze se nazývá zakreslení a v případě dětí léčených v Brně probíhá již na pracovišti radioterapie na Masarykově Onkologickém ústavu na Žlutém kopci. Zakreslení trvá většinou 2 - 3 dny a poté ihned navazuje samotná radioterapie.
Celková dávkapodaná na ozařovanou oblast se liší podle typu nádoru, stáří dítěte, charakteru ozařované tkáně atd. Pohybuje se většinou od 12 do 55 Gy. Dávka je podána rozděleně do tzv. frakcí, kdy většinou 1 frakce představuje 1,2 Gy a je podána během cca 20 minut a to jedenkrát během dne. V průběhu ozařování je nutná spolupráce dítěte. Nejmenší děti musí tento výkon absolvovat v krátké anestezii.
Nežádoucí účinky:
Stejně jako chemoterapie, je i radioterapie do jisté míry slepá a postihuje mimo nádorových i buňky zdravé, nacházející se v blízkosti ozařovaného pole. Zdravá buňka je ale, na rozdíl od nádorové, schopna rychlejší reparace. Poškození zdravých buněk je příčinou nežádoucích účinků radioterapie. Ty lze podle návaznosti na radioterapii rozdělit na akutní a chronické.
Akutnívznikají v průběhu nebo do 6 týdnů po radioterapii. Jedná se o útlum krvetvorby, poškození sliznic a kůže, trvalou epilaci, průjmy, zvracení.
Chronické změnyjsou závažnější, mohou mít doživotní následky a jsou hlavním důvodem pro velmi uvážlivou indikaci radioterapie v dětském věku. V důsledku účinku záření na rostoucí organismus může dojít v ozařovaném poli k zástavě růstu tkání a vývoji růstových deformit. Devastující účinek má záření na pohlavní orgány - vaječníky a varlata. I po těch nejnižších léčebných dávkách dochází k trvalé sterilitě. Pokud se nacházejí tyto orgány v ozařovaném poli a nejsou zároveň cílem ozařování, je snaha je před radioterapií z operačního pole odsunout a to i za cenu operačního zákroku (např. přesun vaječníků za dělohu při ozařování malé pánve).
Samo radiační záření ale může zhoubné bujení vyvolat, čehož je smutným důkazem prudké zvýšení frekvence zhoubného bujení obyvatel Nagasaki,Hirošimy a Černobylu. Vztah radiačního záření a vzniku zhoubného bujení je nyní ale již dobře prozkoumán. K rozvoji sekundární malignity dochází v ozařované oblasti v průměru 15 let od konce léčby. Současné ozařovací plány pro děti jsou postaveny tak, aby se riziko vzniku malignity minimalizovalo. Při stávajících přísných kriteriích indikace radioterapie je riziko vzniku sekundární malignity mnohonásobně převýšeno přínosem radioterapie.
Život po ukončení léčby
"Vše jednou končí a někdy je to dobře."
Proces onkologické léčby však často změní život dítěte i celé rodiny natolik, že se obtížně vrací do původních kolejí, nevěří, že mohou žít jako dříve a žijí v permanentním strachu z návratu nemoci. Vzhledem k tomu, že si všechny pacienty necháváme v dispenzární ambulantní péči do věku 18 let, a někdy i déle, setkáváme se všemi běžnými problémy, které je po ukončení léčby potkávají. Zde je našich několik rad a odpovědí.
Vrátí se nemoc ?
Nevíme a nikdo to neví. V rámci následných ambulantních kontrol po ukončení léčby se zaměřujeme i na včasné známky případného návratu nemoci. S každým rokem po ukončení léčby se ale pravděpodobnost návratu nemoci snižuje, a po 5 letech je zcela minimální. V současně době se většina onkologicky nemocných dětí vyléčí, což znamená, že se nemoc nevrátí a děti dále žijí zcela normálním životem.
Můžu sportovat ?
Ano. A je to navíc velmi vhodné. Podle charakteru onemocnění a léčby je velmi individuální, kdy začít sportovat a jak intenzivně, ale v zásadě by se v průběhu času naprostá většina pacientů měla fyzickou aktivitou vyrovnat svým vrstevníkům. Výzkumy bohužel prokázaly, že část rodičů svým dětem po onkologické léčbě zbytečně v normální fyzické aktivitě brání. Tyto děti jsou tak nejenom dále vyřazovány ze skupiny svých vrstevníků, ale často trpí i nadváhou a s ní spojenými chorobami.
Můžu jet k moři ?
Pobyt u moře se většinou nedoporučuje v prvním roce po ukončení léčby, i když důvody nejsou zcela jasné. Je obava z prudké reakce kůže na intenzivní sluneční záření, špatné adaptace organismu na vysoké teploty a také ze stále přetrvávající nižší odolnosti proti infekčních chorobám. Přímou souvislost mezi pobytem u moře a rizikem návratu choroby nikdo neprokázal.
V dalších letech po léčbě není proti pobytu u moře námitek s tím, že platí stejná pravidla slunění a hygieny jako pro kohokoliv jiného. Opalování jednoduše zdravé není, ať je člověk po onkologické léčbě nebo ne.
Mám omezení ve výběru povolání ?
To je velmi individuální. Samotný fakt, že pacient prodělal onkologickou léčbu, ho z žádného povolání nediskriminuje. Záleží spíše na případných trvalých následcích, které nemoc a léčba zanechá. Například pacientů s postižením pohybového aparátu, po operacích páteře a velkých kloubů nedoporučujeme povolání se zvýšenou, především jednostrannou, fyzickou zátěží. Pacienti s postižením plic by se měli vyvarovat pobytu v prašném prostředí.
Mohu mít děti ? A kdy ? Budou zdravé ?
Na tuto otázku jsme již částečně odpověděli v části komplikace onkologické léčby. Bohužel někdy je cenou za vyléčení ztráta plodnosti, i když díky pokrokům v oblasti reprodukční medicíny je stále větší část pacientů schopna mít po ukončení chemoterapie zdravé dítě. Průzkumy opakovaně prokazují, že pacienti po prodělané onkologické léčbě nemají významně vyšší riziko narození dítěte s vrozenou vadou. Těhotenství doporučujeme nejdříve za 3 – 5 let po ukončení léčby, tak aby organismus byl takové zátěže schopen.
Proč se cítím starší mezi svými vrstevníky ?
To je normální pocit člověka, který projde zkušeností s onkologickou léčbou ve věku kolem dospívání. V době sdělení diagnózy a potom i v průběhu léčby si člověk projde okamžiky, kdy cítí ohrožení života. V boji s nemocí sáhne až dno svých sil, o kterém dosud neměl ani tušení a současně je i svědkem utrpení a boje ostatních pacientů. Díky tomuto prožitku člověk může cítit vnitřní vydělenost z bezstarostného světa svých zdravých vrstevníků, pocit izolace a nepochopení. Je nutné si uvědomit, že to, co mě činí jiným, je ve mně, pro ostatní neviditelné a tak jen já to mohu změnit . Tím, že se pokusím ve své mysli udělat za nemocí tlustou čáru a vnímat svět kamarádů jako můj skutečný správný svět, ve kterém je mé místo. Jistě, prožitek z nemoci nelze jen tak smazat. Je třeba si z něho uchovat vědomí, že jsem schopen ledacos překonat, ale nesmí se stát otravnou koulí na noze.
Na tomto místě chceme znovu zdůraznit obrovskou důležitost včasné profesionální psychologické pomoci, jak pro pacienta, tak pro jeho rodinu. Ne všechno je člověk schopen zvládnou sám, i přesto, že moc chce.
Nadační fond dětské onkologie Krtek (NFDO Krtek) se svojí činností zaměřuje na podporu komplexní péče o onkologicky nemocné děti absolvující léčbu na Klinice dětské onkologie Fakultní nemocnice v Brně (KDO FN Brno) a LF MU Brno ve prospěch onkologicky nemocných kojenců, dětí a dospívající mládeže. Více informací o Nadačním fondu Krtek naleznete na www.krtek-nf.cz.
Slovníček pojmů
|
adjuvantní |
pomocný; chemoterapie podávaná po radikálním operačním zákroku (viz neoadjuvantní) |
|
adrenální |
ležící u ledviny |
|
agranulocytóza |
úplné vymizení granulocytů |
|
alogenní transplantace kostní dřeně |
transplatace kostní dřeně od dárce |
|
alopecie |
ztráta vlasů; po cytostatikách je alopecie dočasná |
|
amplifikace |
zvětšení, zmnožení, zesílení |
|
anémie |
chudokrevnost, úbytek červených krvinek, v užším slovy smyslu ochuzení krve o krevní barvivo |
|
anestezie |
znecitlivění, ztráta vnímání dotyku, bolesti apod. |
|
antigeny |
znaky vyvolávající tvorbu protilátek |
|
antimykotika |
léky s protiplísňovým účinkem |
|
ascites |
nahromadění tekutiny v břišní dutině |
|
aspirace |
vdechnutí, odsávání |
|
atrofie |
zmenšení normálně vyvinutého orgánu, na němž se podílí úbytek jeho buněk nebo zmenšení jejich velikosti |
|
autologní transplantace kostní dřeně |
pacient je sám sobě dárcem |
|
ABMT |
autologní transplantace kostní dřeně |
|
bazofil |
druh zralé bílé krvinky |
|
bazofilie |
zmnožení bazofilů |
|
B-buňky |
druh zralých bílých krvinek, typ lymfocytů |
|
benigní |
nezhoubný |
|
bilaterální |
dvoustranný, oboustraný |
|
biopsie |
odběr malého vzorku tkáně k vyšetření |
|
blast |
nezralá buňka, často nádorového původu |
|
BM |
kostní dřeň |
|
BMT |
transplantace kostní dřeně |
|
Ca |
kalcium |
|
cerebellum |
mozeček, malý mozek |
|
cerebro- |
ve složeninách mozko- |
|
cerebrum |
mozek |
|
CNS |
centrální nervový systém - mozek a páteř |
|
CPM |
cyklofosfamid - cytostatikum |
|
conditioning |
("kondišening") několikadenní podávání vysokých dávek cytostatik, někdy v kombinaci s celotělovým ozářením, před transplantací kostní dřeně |
|
CR |
úplná remise |
|
CSF |
mozkomíšní mok |
|
CT |
počítačová tomografie |
|
cytogenetika |
vědecké odvětví zkoumající dědičnost na úrovni buňky |
|
cytokiny |
produkty krevních buněk, které ovlivňují jejich funkci |
|
cytomegalová infekce |
infekce určitým druhem viru, který u zdravého člověka nemusí vyvolat onemocnění, ale např. u pacientů po transplantaci kostní dřeně může způsobit závažný stav |
|
cytostatikum |
látka tlumící růst a rozmnožování buněk, hlavně nádorových |
|
dekontaminace |
odstranění cizích a škodlivých látek z těla |
|
diagnostikovat |
určovat, rozpoznávat nemoci |
|
dialýza |
vyčištění krve od škodlivých látek, které jsou za normálních okolností z těla odstraňovány ledvinami |
|
dimetylsulfoxid |
látka k uchování kostní dřeně |
|
DNA |
deoxyribonukleová kyselina |
|
drén |
pomůcka k odvádění tekutin např. z ran |
|
EBV |
Epstein-Barrův virus |
|
EEG |
elektroencefalogram - snímání mozku |
|
EKG |
elektrokardiogram - snímání srdce |
|
empirický |
získaný zkušeností, vyplývající ze zkušenosti (na rozdíl od poznání skutečné podstaty) |
|
endogenní |
vnitřní, vznikající uvnitř lidského organismu; opak exogenní |
|
endokrinní funkce |
funkce žláz s vnitřním vyměšováním |
|
engraftment |
přihojení |
|
enzymy |
látky ovlivňující chemické pochody v těle |
|
eozinofilie |
zmnožení eozinofilů |
|
eozinopenie |
úbytek eozinofilů |
|
epilace |
trvalé odstranění chloupků, tj. destrukce jejich růstového centra |
|
erytrocytóza |
zmnožení červených krvinek |
|
erytrocyty |
červené krvinky |
|
etiologie |
příčina nemoci, věda zabývající se příčinami nemocí |
|
exogenní |
zevní, mimo lidský organismus; opak endogenní |
|
fagocytovat |
pohlcovat |
|
febrilní |
provázený horečkou, zvýšenou tělesnou teplotou nad 38 stuňů |
|
fetální buňky |
zárodečné buňky |
|
fibróza |
zmnožení vaziva v určitém orgánu na úkor funkční tkáně |
|
GCT |
nádor ze zárodečných (germinálních) buněk |
|
gen |
základní jednotka dědičnosti uložená v chromozomech buněčného jádra |
|
glandula |
žláza |
|
glie |
podpůrná nervová tkáň |
|
glioblastom |
nádor ústředního nervstva z nezralých gliových buněk |
|
gliom |
nádor ústředního nervstva z gliových buněk |
|
glukokortikoidy |
hormony kůry nadledvin |
|
granulocyt |
bílá krvinka se zrnky v plazmatu |
|
granulocytopenie |
viz neutropenie |
|
GVHD |
reakce štěpu (kostní dřeně) proti příjemci |
|
Gy |
Gray - jednotka záření |
|
HD |
Hodgkinova choroba (lymfom) |
|
HD |
vysoká dávka |
|
hematokrit |
poměr červených krvinek k celkovému objemu krve |
|
hemoglobin |
červené krevní barvivo |
|
HLA |
hlavní systém znaků buněk u člověka |
|
Hodgkinova choroba |
nádor lymfatické tkáně |
|
HR |
vysoký stupeň rizika |
|
humorální imunita |
protilátková obranyschopnost |
|
hydratace |
zavodnění organismu, důležitý předpoklad jeho funkce |
|
hypo- |
pod, dole, ve složeninách značí nízkou úroveň, pokles |
|
hypothalamus |
část mozku kolem třetí komory |
|
chemoterapie |
léčení nemocí pomocí chemických prostředků |
|
chromozom |
vláknitá struktura buněčného jádra, v níž je v podobě DNA v genech obsažena dědičná informace |
|
IM |
intramuskulární |
|
imunita |
schopnost organismu bránit se proti cizorodým látkám a patogenům |
|
imunocyt |
buňka zabezpečující obranyschopnost |
|
imunodeficit |
porucha obranyschopnosti |
|
imunoglobuliny |
bílkoviny, které jsou nositelkami protilátkové aktivity organismu; podílejí se na obranyschopnosti |
|
imunosupresivní léky |
látky potlačující obranyschopnost |
|
imunoterapie |
léčba upravující obranyschopnost organismu |
|
indikace |
léčebný příkaz, soubor okolností, které vedou k určitému léčebnému postupu nebo zákroku |
|
infúze |
podání roztoku do cévního systému (do žíly) |
|
interleukin |
látka umožňující spolupráci bílých krvinek |
|
intramuskulární |
nitrosvalový |
|
intravenózní |
nitrožilní |
|
inzulín |
hormon slinivky břišní, ovlivňující přepravu cukru z krve do buněk |
|
ireverzibilní |
nevratný |
|
IV |
intravenózní |
|
jaterní testy |
souhrn laboratorních biochemických vyšetření krve určených k posouzení stavu jater |
|
juvenilní |
týkající se mládí, zejm. dospívajících |
|
kalcium |
vápník |
|
kalium |
draslík |
|
kancerogenní |
vyvolávající nádorový růst |
|
katetr |
cévka zaváděná do dutých orgánů |
|
klon |
skupina stejných buněk, které vznikly dělením jedné buňky |
|
kmenové buňky |
buňky původem z kostní dřeně, ze kterých se vyvíjejí krvinky |
|
kóma |
stav hlubokého bezvědomí |
|
komplement |
systém bílkovin, které se podílejí na obranyschopnosti organismu |
|
kontraindikace |
jakýkoli stav pacienta, který znemožňuje (zakazuje) provedenín určitého lékařského nebo diagnostického výkonu včetně podání určitých léků |
|
kryobanky |
zařízení sloužící k uchování tkáně ve zmrazeném stavu |
|
kryokonzervace |
uchování vzorku při velmi nízkých teplotách |
|
kultivace |
pěstování organismů na umělých půdách k tomu určených |
|
L1-L5 |
bederní obratle |
|
letální |
smrtící (např. L. dávka, L. průběh nemoci) |
|
leukémie |
krevní choroba způsobená poruchou ve vývoji bílých krvinek |
|
leukocyty |
bílé krvinky obecně |
|
leukopenie |
úbytek leukocytů |
|
lumbální punkce |
odběr mozkomíšního moku z páteřního kanálu |
|
lymfa |
míza |
|
lymfadenopatie |
blíže neurčené zvětšení lymfatických uzlin |
|
lymfatické uzliny |
mízní uzliny |
|
lymfoblast |
nezralá bílá krvinka |
|
lymfocytopenie |
úbytek lymfocytů |
|
lymfocytóza |
zmnožení lymfocytů |
|
lymfom |
nádor mízních uzlin |
|
magnézium |
hořčík |
|
maligní |
zhoubný |
|
malnutricie |
podvýživa, zejm. ve smyslu špatného složení potravy |
|
megakaryocyt |
předchůdce krevních destiček v kostní dřeni |
|
megaterapie |
vysokodávkovaná léčba |
|
mesenchym |
tkáň ze středního zárodečného listu (mesodermu), pojivová, podpůrná tkáň |
|
Mg |
magnézium |
|
mIBG |
("em-aj-bí-dží") radioaktivní meta-iodobenzylguanidin (mIBG snímání nebo mIBG terapie) |
|
minimální reziduální nemoc |
nejmenší množství nádorovývh buněk, které lze zjistit určitým vyšetřením a které mohou způsobit nové vzplanutí onemocnění |
|
mitóza |
buněčné dělení, při němž z jedné buňky vznikají dvě bunky dceřinné, které mají zcela stejnou dědičnou výbavu |
|
míza |
čirá, mírně zkalená tekutina, obsahující stejně solí jako krevní plazma, ale méně bílkovin; jsou v ní obsaženy lymfocyty; odvádí z tkání metabolity |
|
mízní uzliny |
uzliny na dráze mízních cév, vyplněny lymfocyty, zadržují prach, mikroorganismy, buňky, části buněk |
|
mM |
mili mol (jednotka látkového množství) |
|
mnohočetný myelom |
nádorové onemocnění kostní dřeně |
|
molekulárněgenetická laboratoř |
laboratoř zkoumající genetickou výbavu lidských buněk a její změny |
|
monoblast |
nezralá bílá krvinka |
|
monocytopenie |
úbytek monocytů |
|
monocytóza |
zmnožení monocytů |
|
MR |
snímání metodou magnetické rezonance |
|
natrium |
sodík |
|
nausea |
pocit nevolnosti, nucení ke zvracení |
|
neoadjuvantní |
chemoterapie podávaná před eventuálním radikálním operačním zákrokem (viz adjuvantní) |
|
neuroblastom |
nádor z periferní nervové tkáně sympatiku |
|
neuroektodermatosa |
souborné označení chorob vzniklých vývojovou poruchou a vyznačených hlavně změnami kožními a nervové soustavy |
|
neurotropní |
mající afinitu (vztah) k nervové tkáni |
|
neutrofil |
druh zralé bílé krvinky |
|
neutrofilie |
zmnožení neutrofilů |
|
neutropenie |
snížení počtu neutrofilních bílých krvinek v krevním obrazu |
|
ne-Hodgkinův Lymfom |
nádor lymfatické tkáně |
|
NHL |
ne-Hodgkinův lymfom |
|
onkogen |
gen, jehož porucha může způsobit vznik zhoubného bujení |
|
onkogeneze |
původ a vývoj nádoru |
|
onkologie |
lékařský obor zabývající se výzkumem, diagnózou a léčbou nádorových onemocnění |
|
OS |
osteogenní sarkom |
|
osteo- |
označuje kost |
|
pancytopenie |
úbytek veškerých krevních buněk |
|
parasympatické nervy |
vystupují z mozku a z křížové míchy a vstupují do malých parasympatických ganglií v blízkosti inervovaných vnitřních orgánů |
|
PBSC |
kmenové buňky, které kolují v periferní krvi |
|
PBSCT |
transplantace kmenových buněk periferní krve |
|
periferní krev |
krev v žilách |
|
peristaltika |
rytmické smršťování svalstva trávicí trubice (střev a žaludku) |
|
pineální |
ležící v oblasti šišinky |
|
plazma |
tekutá složka krve |
|
plazmatické buňky |
buňky tvořící protilátky |
|
-ploidie |
přípona označující počet chromozomů v buňce |
|
PNET |
periferní neuroektodermální tumor |
|
PNET |
primitivní neuroektodermální tumor |
|
polycytémie |
zmnožení červených krvinek |
|
polymorfocelulární |
mnohotvarý |
|
predikovat |
poskytovat předpověď,odhad do budoucna |
|
prediktor |
prvek poskytující určitou predikci (předpověď, odhad do budoucna) |
|
prekurzorové buňky |
méně zralé krvetvorné buňky dané vývojové řady |
|
prenatální |
před narozením |
|
progenitorové buňky |
nejméně zralé krvetvorné buňky, ze kterých mohou vznikat všechny druhy krvinek |
|
prognóza |
předpověď, předurčení průběhu choroby a konečného výsledku léčení |
|
progrese |
postup, pokračování |
|
prolymfocyt |
stádium ve vyzrávání bílé krvinky |
|
promonocyt |
stádium ve vyzrávání bílé krvinky |
|
promyelocyt |
stádium ve vyzrávání bílé krvinky |
|
protein |
bílkovina |
|
pupečníková krev |
krev z pupečníkové šňůry plodu bohatá na krvetvorné buňky |
|
purging |
("pérdžing") čištění; zpravidla čištění štěpu - odebrání dřeně či PBSC |
|
QRS komplex |
komorový komplex - soubor navazujích kmitů na elektrokardiogramu (EKG), který je grafickým záznamem šíření elektrického impulsu v srdečních komorách |
|
radiace |
záření |
|
radioterapie |
léčba ozařováním paprsky velmi krátké vlnové délky |
|
receptor |
molekula na povrchu nebo uvnitř buňky, která je schopna rozeznat jinou molekulu v okolí, navázat ji a informovat ostatní buňky o její přítomnosti |
|
rektum |
konečník |
|
relaps |
znovuvzplanutí nemoci |
|
relaxační techniky |
uvolňovací techniky |
|
remise |
klidová fáze nemoci, stav, kdy nelze nemoc prokázat běžnými metodami a vymizí příznaky choroby |
|
resekce |
vynětí, vyříznutí, chirurgické odstranění části tkáně nebo orgánu |
|
residuum |
zbytek |
|
reverzibilní |
zvratný |
|
reziduální |
zbytkový, doznívající |
|
rezistentní |
nereagující na léčbu |
|
RNA |
ribonukleová kyselina |
|
růstové faktory |
látky podporující krvetvorbu |
|
sarkom |
mesenchymový zhoubný nádor (z podpůrných tkání), blíže označovaný podle tkáně, z níž vychází |
|
screening |
provádění preventivních zdravotních testů na skupinách obyvatel se záměrem zachytit možné vznikající onemocnění již v raném stádiu |
|
separace |
oddělení; zpravidla s. kmenových buněk |
|
sepse |
stav, při němž se z infekčního ložiska v těle občas či trvale uvolňují choroboplodné zárodky do krve ("otrava krve") a poškozují ostatní orgány; S. šok |
|
skenování |
druh snímání obrazu, při kterém je snímaný obraz rozkládán např. do řádků, ze kterých se poté složí výsledný obraz (např. řádkování u televize) |
|
solidní nádor |
pevný (často ohraničený) nádor, opakem je tzv. tekutý nádor |
|
sputum |
chrchel, to co je vykašláváno, "hlen" (hlenové, hnisavé, hnilobné, krvavé) |
|
stereotaxe |
neurochirurgická metoda umožňující pomocí složitých trojrozměrných výpočtů zacílit na chorobné ložisko v mozku a operovat ho použitím dalších technik, např. radioaktivními paprsky gama nože |
|
sternální punkce |
odběr kostní dřeně z hrudní kosti |
|
subkutánní |
podkožní |
|
supraselární |
ležící nad tureckým sedlem kosti klínové |
|
suprese |
útlum, potlačení |
|
supresorové T-lymfocyty |
druh zralých bílých krvinek |
|
suspenze |
přípravek obsahující pevnou látku (např. buňky) v kapalině |
|
sympatické nervy |
vystupují z míchy krční, hrudní a bederní a končí ve vegetativních uzlinách, odtud začínají nová nervová vlákna, inervující příslušné orgány |
|
syngenní transplantace kostní dřeně |
dárcem je jednovaječné dvojče |
|
systémové onemocnění |
onemocnění postihující více orgánů |
|
šok |
těžký, život ohrožující stav, při němž dochází k selhání krevního oběhu a těžké poruše prokrvení tkání a orgánů lidského organismu; dochází k těžké poruše funkcí prakticky všech životně důležitých orgánů |
|
T-buňky |
druh zralých bílých krvinek, typ lymfocytů |
|
tekutý nádor |
nádor, který je opakem tzv. pevného nádoru; zpravidla leukémie |
|
terapie |
léčba |
|
toxiny |
jedovaté látky |
|
translokace |
přestavba chromozomů, změna v genetickém vybavení lidské buňky |
|
trombocytopenie |
úbytek trombocytů |
|
trombocytóza |
zmnožení trombocytů |
|
trombocyty |
krevní destičky |
|
tu |
zkratka pro tumor |
|
tumor |
nádor, novotvar; místní bezúčelné a nadměrné bujení tkáně, vycházející z buněk vlastního těla s trvalým růstem bez zřetele k potřebám organismu |
|
ultrazvuk |
zvuk nad horní hranicí slyšitelnosti lidského ucha; v lékařství se používá k neinvazivnímu zobrazování tkání uvnitř organismu nebo plodu |
|
uretra |
močová trubice |
|
UV |
ultrafialový |
|
UZ |
ultrazvuk |
|
VM-26 |
teniposid (protinádorový preparát) |
|
VP-16 |
etoposid (protinádorový preparát) |
|
WHO |
Světová zdravotnická organizace |
|
xanthos |
žlutý |
|
|
|
zánět |
obranná reakce tkáně a orgánu na poškození |
|
záření |
způsob šíření energie |